再生医療や基礎研究の現場において、細胞培養はあらゆる実験の根幹をなす極めて重要な技術です。しかし、どれほど高価な試薬や最新の機器を使用しても、日々の基本操作が疎かであれば、信頼性の高いデータを得ることはできません。些細な手順の違いや手癖が、細胞の状態を変え、実験の再現性を損なう原因となることさえあるのです。
本記事では、これから培養業務を始める若手研究員の方や、改めて手技を見直したい技術スタッフの方に向けて、細胞培養の基本プロトコルと注意点を体系的に解説いたします。無菌操作の基本から、解凍・継代・凍結保存といった一連の流れにおける「なぜその操作が必要なのか」という理由まで、現場ですぐに役立つ実践的な知識を整理しました。正しい知識と技術を身につけ、安定した培養結果を目指しましょう。
細胞培養の成功は「無菌操作」の徹底と標準手順の遵守にある
細胞培養の成功において最も重要なのは、徹底した「無菌操作」と、定められた手順を忠実に守る姿勢です。どんなに優れた細胞株を用いていても、一度のコンタミネーションや操作ミスですべてが水泡に帰すことも珍しくありません。ここでは、技術的な手技に入る前に、研究者として持つべき心構えと基盤となる考え方について解説します。
実験の再現性を確保するためのSOP(標準作業手順書)の重要性
実験の再現性を担保するためには、誰が操作しても同じ結果が得られるよう、SOP(標準作業手順書)を作成し、遵守することが不可欠です。細胞培養は属人化しやすい業務ですが、担当者による手技のバラつきはデータの信頼性を大きく揺るがします。
具体的には、ピペッティングの速度や撹拌の回数、試薬の温度管理など、細部にわたるルールを明文化しておくことが推奨されます。SOPは単なるマニュアルではなく、研究室全体の品質基準を守るための「法律」のような存在です。まずは既存のSOPを熟読し、疑問点があれば自己判断せずに先輩や管理者に確認することから始めましょう。
コンタミネーション(汚染)リスクを最小化する心構え
コンタミネーション(汚染)は、細胞培養における最大のリスクであり、常に「見えない敵」と戦っているという意識を持つ必要があります。細菌や真菌、マイコプラズマは空気中や実験者の身体、器具などあらゆる場所に存在しています。
操作中は、「清潔なもの」と「不潔なもの」を空間的に明確に区別し、清潔なエリアに不潔なものを持ち込まない動線を意識することが重要です。例えば、ピペットの先端が何にも触れないようにする、容器の蓋を開けたまま放置しないといった基本的な所作を、無意識レベルで実践できるようになるまで訓練しましょう。この高い意識こそが、貴重な細胞を守る盾となります。
細胞の品質維持が再生医療研究に与える影響
細胞は生き物であり、その品質は培養環境や操作方法によって敏感に変化します。適切な継代タイミングを逃したり、物理的なダメージを与え続けたりすると、細胞の増殖能や分化能が低下し、本来の特性が失われる可能性があります。
特に再生医療研究においては、細胞そのものが「製品」や「治療の種」となるため、品質の劣化は研究データの信憑性を損なうだけでなく、将来的な治療効果にも悪影響を及ぼしかねません。日々の観察を通じて細胞のわずかな変化を感じ取り、常に最良の状態(コンディション)を維持することが、研究全体の質を高めることにつながります。
細胞培養を始める前の環境整備と準備における注意点
実際の培養操作を始める前の準備段階こそが、コンタミネーションを防ぎ、スムーズな実験を行うための鍵を握っています。「段取り八分」と言われるように、環境整備と準備を万全に行うことで、操作中のミスやリスクを大幅に減らすことができます。ここでは、安全キャビネットの使用法から身だしなみまで、培養室に入る前に確認すべきポイントを整理します。
安全キャビネット(クリーンベンチ)内の整頓と気流の確保
安全キャビネット(クリーンベンチ)は、内部を無菌的な気流で満たすことで細胞を保護しています。そのため、気流を妨げないような物品配置が求められます。作業スペースの奥にある吸気グリルを試薬ボトルや機器で塞いでしまうと、適切なエアカーテンが形成されず、コンタミネーションの原因となります。
作業を始める前には、キャビネット内を整理整頓し、必要なものだけを最小限持ち込むようにしましょう。また、手を入れる際は急激な動作を避け、気流の乱れを最小限に抑えるよう意識することが大切です。広々とした作業スペースを確保することは、操作ミスを防ぐことにもつながります。
70%エタノールによる手指と器具の適切な消毒方法
70%エタノールは細胞培養における最も基本的な消毒ツールですが、正しい使い方を理解していないと効果が半減します。重要なのは、エタノールを噴霧した後、それが「揮発して乾く瞬間」に殺菌効果が最大になるという点です。
手指の消毒はもちろん、キャビネット内に持ち込む試薬ボトル、ピペットのパッケージ、チューブスタンドなども、すべて70%エタノールを含ませたキムタオル等で丁寧に清拭します。単に吹きかけるだけでなく、表面全体を拭き上げる物理的な除去効果も組み合わせることで、より確実な除染が可能となります。
培地・試薬の予備加温と使用期限の確認
細胞にとって急激な温度変化は大きなストレスとなります。使用する培地やトリプシンなどの試薬は、あらかじめ37℃のウォーターバスなどで適温に温めておくことが基本です。冷たい試薬をそのまま使用すると、細胞が剥がれにくくなったり、活性が低下したりする原因となります。
一方で、培地に含まれるグルタミンや成長因子などの成分は熱に弱いため、長時間の加温や繰り返しの加温・冷却は避けるべきです。使用期限の確認と併せて、その日に使用する分だけを分注して温めるなど、試薬の品質管理にも気を配りましょう。
コンタミネーションを防ぐための服装と防護具の着用
実験者自身が最大の汚染源であることを忘れてはいけません。培養室に入室する際は、専用の白衣、マスク、手袋を正しく着用し、皮膚や髪の毛の露出を極力抑えることが求められます。特に袖口は汚れやすいため、手袋を白衣の袖の上に被せるように装着し、隙間を作らないようにするのがポイントです。
また、実験の前には手洗いを徹底し、アクセサリー類は外しましょう。化粧品や整髪料の粉塵もコンタミネーションのリスクとなるため、控えめにするか、帽子などでしっかりカバーすることが推奨されます。清潔な服装は、細胞を守るための第一の防壁です。
【基本プロトコル1】細胞の解凍(Thawing)の手順とポイント
凍結保存されていた細胞を起こす「解凍(Thawing)」は、細胞培養のスタート地点であり、細胞に大きなストレスがかかる工程です。ここでの操作が、その後の細胞の増殖や生存率を決定づけると言っても過言ではありません。氷晶によるダメージを防ぎ、毒性のある凍結保護剤を速やかに除去するための、迅速かつ丁寧なプロトコルを解説します。
液体窒素からの取り出しと迅速な解凍操作
液体窒素タンクから取り出した凍結チューブは、直ちに37℃のウォーターバスへ移動させます。この工程は何よりもスピードが命です。緩慢な解凍は細胞内に氷の結晶を再形成させ、細胞膜を破壊する原因となるからです。
チューブをウォーターバスに入れたら、静かに振とうしながら解凍を進めます。完全に溶けきる直前、氷の塊がわずかに残っている状態で引き上げるのがベストタイミングです。これにより、解凍後の温度上昇による細胞へのダメージを防ぐことができます。取り出した後は、チューブ表面を70%エタノールで念入りに消毒してからキャビネット内へ持ち込みましょう。
遠心分離による凍結保護剤(DMSO)の完全除去
凍結保存液には、細胞を凍結ダメージから守るためにDMSO(ジメチルスルホキシド)が含まれていますが、これは融解後の細胞にとっては毒性を示します。そのため、解凍後は速やかに遠心分離を行い、DMSOを含む上清を除去する必要があります。
解凍した細胞懸濁液を、あらかじめ用意した新鮮な培地が入った遠心管にゆっくりと移し、適切な条件(一般的な細胞では約1000rpm、3〜5分程度)で遠心します。遠心後は上清をアスピレーターで丁寧に取り除きますが、この際、底に沈んだ細胞ペレット(塊)を吸い込まないよう細心の注意を払いましょう。
細胞生存率を高めるための再懸濁と播種密度の調整
上清を除去した後、新しい培地を加えて細胞ペレットを再懸濁します。この時、ピペッティングが強すぎると細胞に物理的なダメージを与えてしまうため、優しく数回吹き出すようにして細胞をほぐします。完全にシングルセル(単一細胞)にする必要はありませんが、大きな塊が残らない程度に分散させましょう。
播種密度(Seeding Density)は細胞の種類によって最適値が異なりますが、解凍直後は通常よりもやや高めの密度で播種することが一般的です。細胞同士が近接している方が、互いに生存シグナルを出し合い、定着率が向上するためです。
培養開始翌日の細胞接着確認と培地交換
培養を開始した翌日には、必ず顕微鏡で細胞の状態を確認します。無事に接着して伸展しているか、形態に異常はないかをチェックしましょう。この際、接着しなかった死細胞が浮遊していることが多いため、一度培地交換を行うことをお勧めします。
死細胞から放出される内容物は、生きている細胞にとって有害な環境を作り出す可能性があります。新鮮な培地に交換することで、細胞にとってクリーンで栄養豊富な環境を整え、その後の増殖をスムーズに促すことができます。ここまでのケアを行って初めて、解凍プロセスが完了したと言えるでしょう。
【基本プロトコル2】細胞観察と培地交換(Medium Change)
日々の細胞観察と適切なタイミングでの培地交換は、細胞の健康状態を維持するための基本ルーチンです。単に餌を与えるだけでなく、細胞からのサインを読み取り、環境を最適化するプロセスでもあります。ここでは、観察のポイントから、コンタミを防ぐピペッティング操作まで、日常管理における重要事項を詳しく見ていきます。
倒立顕微鏡を用いたコンフルエント率と細胞形態の観察
培養室に入ったら、まずは倒立顕微鏡で細胞の様子を観察します。見るべきポイントは、細胞密度(コンフルエント率)、細胞の形態、そして培地の色や濁りです。細胞が本来の形をしているか、細胞質に空胞(ストレスサイン)が出ていないか、浮遊している死細胞が増えていないかを入念にチェックしましょう。
また、コンフルエント率は継代のタイミングを計る重要な指標です。一般的に70〜80%程度になったら継代を行いますが、過密になると増殖阻害や形質変化が起こるため、毎日の観察で増殖スピードを把握しておくことが大切です。
古い培地の吸引除去時における注意点
培地交換の際、古い培地をアスピレーターで吸引除去しますが、ここにもコツがあります。パスツールピペットの先端を培養容器の底面に直接当てると、接着している細胞を剥がしたり傷つけたりする恐れがあります。
容器を少し傾け、培地が溜まるコーナー部分の壁面にピペットの先端を軽く当てるようにして、静かに吸引しましょう。また、完全に乾燥させてしまうと細胞が死滅するため、吸引後は速やかに新しい培地を添加する必要があります。手際よく、かつ愛護的な操作が求められる瞬間です。
ピペッティング操作による泡立ち防止とクロスコンタミ対策
新しい培地を注ぐ際や混和する際のピペッティング操作では、「泡立てない」ことが鉄則です。泡が弾ける際の物理的衝撃は細胞にダメージを与えるほか、タンパク質の変性を招き、泡が容器の縁に付着することでカビや細菌の温床(コンタミネーションのリスク)にもなり得ます。
培地を加えるときは、ピペットの先端を容器の壁面に沿わせ、ゆっくりと液を流し込むようにします。細胞に直接勢いよく吹きかけるのは厳禁です。丁寧なピペッティングは、クロスコンタミネーション(他の細胞株の混入)を防ぐ上でも有効な手段となります。
培地交換の頻度決定とスケジューリング
培地交換の頻度は、細胞の種類や増殖速度、播種密度によって異なりますが、一般的には2〜3日に1回が目安です。しかし、細胞数が増えてくると栄養分の消費が早くなり、老廃物も蓄積するため、毎日交換が必要になる場合もあります。
培地に含まれるフェノールレッド(pH指示薬)の色が黄色っぽく変化していたら、酸性化が進んでいる証拠であり、早急な交換が必要です。週末や休日のスケジュールも考慮し、細胞を飢餓状態にさせないよう、計画的に交換スケジュールを組む習慣をつけましょう。
【基本プロトコル3】継代培養(Passaging)の正確な操作フロー
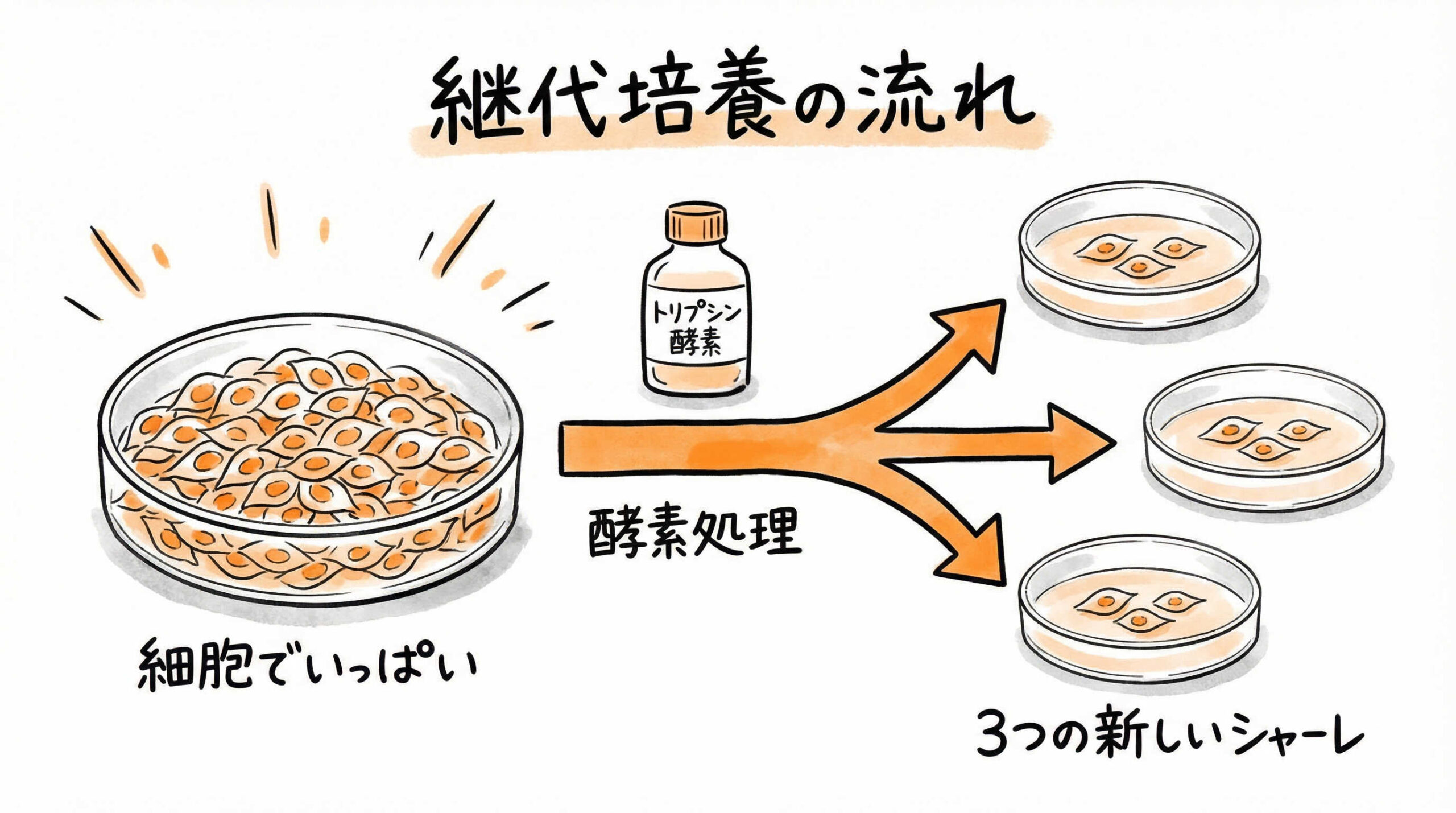
細胞が増殖し、培養容器がいっぱいになったら、新しい容器に移し替える「継代(Passage)」を行います。この工程は、細胞を酵素で剥がすという侵襲的な操作を含むため、手順を誤ると細胞に回復不能なダメージを与えてしまいます。正確な細胞数管理と適切な処理時間を見極めるための、プロフェッショナルな操作フローを解説します。
PBS洗浄による血清成分の除去
培地を除去した後、まずはPBS(リン酸緩衝生理食塩水)を用いて細胞を洗浄します。この工程の主な目的は、培地に含まれる血清成分やカルシウム、マグネシウムを取り除くことです。これらが残っていると、次工程で使用するトリプシンの酵素活性が阻害され、細胞が剥がれにくくなります。
PBSはCa2+/Mg2+フリーのものを使用し、細胞層全体に行き渡るように優しく加えた後、すぐに吸引除去します。洗浄が不十分だとトリプシン処理に時間がかかり、結果として細胞へのダメージが増えるため、確実に行いましょう。
トリプシン・EDTA処理における適正温度と反応時間
細胞を剥離させるためにトリプシン・EDTA溶液を加えます。重要なのは、必要最小限の量と時間で処理を完了させることです。トリプシンを全体に行き渡らせたら、37℃のインキュベーターまたは室温で数分間反応させます。
反応時間は細胞種によって異なりますが、顕微鏡で観察し、細胞が丸くなり始めたら直ちに反応を止める準備をします。長時間放置すると、細胞膜上の重要なタンパク質まで分解され、再接着能の低下や細胞死を招くため、決して目を離さないようにしてください。
タッピングによる細胞剥離と酵素反応の停止
細胞が丸くなってきたら、容器の側面を軽く叩く(タッピング)ことで、物理的な振動を与えて細胞を壁面から剥がします。全ての細胞が剥がれたことを確認したら、直ちに血清入りの新鮮な培地を加えてトリプシンの働きを中和(停止)させます。
血清に含まれるトリプシンインヒビターが酵素反応を止めるため、無血清培地を使用している場合は、専用のトリプシン阻害剤が必要です。この中和ステップが遅れると細胞へのダメージが進行してしまうため、手際よく行うことがポイントです。
ピペッティングによる細胞塊の分散とシングルセル化
剥離した細胞は塊(クランプ)になっていることが多いため、ピペッティングによってバラバラにほぐし、シングルセル化(単一細胞化)します。この操作が不十分だと、正確な細胞数計測ができず、次回の播種密度にムラが生じます。
ピペットマンや電動ピペットを使用し、泡立てないように注意しながら、数回〜十数回程度優しく吹出しと吸い込みを繰り返します。特に凝集しやすい細胞の場合は念入りに行いますが、過度なせん断力(シアストレス)は細胞を傷つけるため、適度な力加減を習得しましょう。
血球計算盤または自動セルカウンターを用いた正確な細胞数計測
継代において最も重要なのが、正確な細胞数の把握です。目分量での継代は再現性を損なう最大の要因です。血球計算盤または自動セルカウンターを使用し、懸濁液中の細胞濃度を測定します。
この際、トリパンブルー染色液を用いて死細胞を区別し、生細胞数のみをカウントすることが基本です。正確なカウントのためには、サンプリング前の十分な撹拌と、適切な希釈倍率の設定が欠かせません。この数値が、次の実験の質を左右すると心得て測定しましょう。
適切な播種密度(Seeding Density)の計算と希釈
計測した細胞濃度をもとに、新しい容器に必要な細胞懸濁液の量と培地の量を計算します。適切な播種密度(例:5,000 cells/cm²など)は細胞ごとに決まっており、少なすぎると増殖が停滞し、多すぎるとすぐに過密状態になります。
計算式を用いて正確に希釈を行い、新しい培養容器に均一に播種します。播種後は、容器を十字に動かすなどして細胞を底面全体に均等に広げることが、ムラのないきれいな培養結果を得るコツです。
【基本プロトコル4】細胞の凍結保存(Cryopreservation)

細胞の凍結保存は、実験の一時中断や、貴重な細胞株のバックアップ作成、そして継代数増加による形質変化(老化)を防ぐために行います。適切な方法で保存された細胞は、数年後でも元気に蘇らせることができます。ここでは、細胞の生存率を高く保ったまま長期保存するための、凍結プロセスの要点を解説します。
対数増殖期(Log phase)にある健全な細胞の回収
凍結保存には、細胞の状態が最も良い時期を選ぶ必要があります。具体的には、対数増殖期(Log phase)にあり、コンフルエント率が70〜80%程度の元気な細胞を使用します。過密状態で増殖が止まった細胞や、状態の悪い細胞を凍結しても、解凍後の生存率(Viability)は低くなります。
凍結前の培地交換を確実に行い、栄養状態を万全にしておくことも大切です。「余ったから凍結する」のではなく、「保存するためにベストな状態で回収する」という意識で計画的に行いましょう。
凍結保存液の組成と冷温での調整
一般的な凍結保存液は、完全培地に10%程度のDMSO(凍結保護剤)を添加して調製します。DMSOは細胞内の水分と置換し、氷晶形成を防ぐ役割を果たしますが、溶解熱(発熱)が発生するため、細胞と混合する前にあらかじめ冷却しておくことが望ましいです。
近年では、血清不含の既製凍結保存液(セルバンカーなど)も広く使用されており、調製の手間やロット差をなくすために有効です。自家調製する場合は、コンタミ防止のためフィルターろ過を行うなど、無菌性を厳重に管理してください。
プログラムフリーザーまたは凍結処理容器を用いた緩慢凍結法
細胞を凍結する際、急激に温度を下げると細胞内が凍って死滅してしまいます。理想的な冷却速度は「1分間に-1℃」と言われており、これを実現するためにプログラムフリーザーや、イソプロパノールを利用した凍結処理容器(BICELLやMr. Frostyなど)を使用します。
細胞懸濁液をクライオチューブに分注したら、これらの容器に入れて-80℃のディープフリーザーで一晩かけてゆっくりと凍結させます。この緩慢凍結プロセスが、解凍後の高い生存率を約束します。
液体窒素タンクへの格納と在庫管理(バンキング)
-80℃での保存はあくまで一時的なものであり、長期保存には液体窒素タンク(-196℃付近)への格納が不可欠です。緩慢凍結が完了した翌日には、速やかに液体窒素タンクへ移しましょう。
保存場所の管理も重要です。どのラックのどのボックスに何の細胞が入っているか、データベースや台帳で厳密に管理(バンキング)します。ラベルには細胞名、継代数、日付、凍結者名を明記し、誰が見てもわかるようにしておくことが、将来の自分やチームを助けることになります。
細胞培養におけるトラブルシューティングと品質管理
細胞培養において、トラブルは避けて通れない課題です。しかし、兆候を早期に発見し、適切な対処を行うことで被害を最小限に食い止めることは可能です。ここでは、最も恐れられるコンタミネーションへの対応から、継代数の限界、機器のメンテナンスまで、品質管理の観点からトラブルシューティングをまとめます。
マイコプラズマ汚染の定期検査と検出時の対応
マイコプラズマは光学顕微鏡では観察できない微小な細菌で、細胞の増殖や代謝に影響を与える厄介な汚染源です。培地が濁らないため発見が遅れがちですが、実験結果に重大なバイアスをかけるため、定期的な検査が必須です。
PCR法や専用の検出キットを用いて、数ヶ月に一度はスクリーニング検査を行うことを推奨します。万が一陽性が確認された場合、抗生物質による除去も可能ですが、基本的には汚染細胞を廃棄し、培養室の徹底的な清掃を行うことが、汚染拡大を防ぐ最善策となります。
細菌・真菌汚染(カビ)の兆候と廃棄ルール
培地が急激に黄色く変色し、白く濁っている場合は細菌汚染、綿毛のような塊が見える場合は真菌(カビ)汚染が疑われます。これらの兆候を見つけたら、即座に培養容器の蓋をきつく閉め、決して開けずに廃棄処分してください。
確認のために蓋を開けたり顕微鏡で見たりする行為は、胞子や菌を部屋中に撒き散らす危険な行為です。汚染が発生したインキュベーターや安全キャビネットは直ちに使用を中止し、アルコールや殺菌剤で徹底的に消毒・滅菌を行う必要があります。
継代数(Passage Number)の限界と細胞老化の影響
正常な体細胞には分裂回数の限界(ヘイフリック限界)があり、継代を重ねすぎると老化して増殖が止まったり、性質が変化したりします。株化細胞であっても、継代数が増えるにつれて遺伝的な変異が蓄積するリスクがあります。
そのため、実験に使用する継代数の上限(例:P20までなど)をあらかじめ決めておくことが重要です。初期の継代数の若い細胞を「マスターセルバンク」、そこから増やしたものを「ワーキングセルバンク」として保存・管理し、常に一定の品質の細胞を使用できる体制を整えましょう。
培養環境(CO2濃度・温度・湿度)の日常点検と校正
細胞はインキュベーター内の環境に依存して生きています。CO2濃度(通常5%)、温度(37℃)、湿度が適切に保たれているか、日常的に表示パネルだけでなく実測値で確認することが大切です。
特に加湿バットの水枯れは培地の蒸発と浸透圧上昇を招き、細胞に致命的なダメージを与えます。滅菌水を定期的に補充し、バット自体も定期的に洗浄・滅菌して清潔を保ちましょう。また、年に一度は専門業者による校正(キャリブレーション)を行い、機器が表示する数値の正確性を担保することも品質管理の一環です。
まとめ
細胞培養は、再生医療やライフサイエンス研究の礎となる技術です。本記事で解説した無菌操作の徹底、SOPの遵守、そして解凍から凍結に至るまでの各プロトコルの正確な実行は、すべて「信頼できるデータ」を得るために不可欠な要素です。
手技の一つひとつには必ず理由があります。「なぜそうするのか」を理解し、日々の観察を通じて細胞の小さな変化に気づけるようになることが、熟練への近道です。基本に忠実であり続けることが、結果として実験の効率を高め、研究の質を向上させることにつながります。ぜひ、今日からの培養業務にこれらのポイントを活かしてみてください。
細胞培養の基本プロトコルと注意点についてよくある質問
以下に、細胞培養の現場でよく聞かれる質問とその回答をまとめました。日々の業務や後輩指導の際にお役立てください。
- Q1. 培地の色がピンク色から赤紫色に変わってきましたが、問題ありませんか?
- 培地がアルカリ性に傾くと赤紫色になります。CO2インキュベーターのCO2濃度が不足しているか、蓋が緩みすぎてガス交換が過剰になっている可能性があります。細胞への影響が出る前に、環境を確認しましょう。
- Q2. 凍結細胞を解凍した際、生存率が低い原因は何でしょうか?
- 解凍に時間がかかりすぎている、または凍結時の細胞状態が悪かった(過密、老化など)可能性が高いです。解凍は37℃で急速に行い、凍結は対数増殖期の元気な細胞で行うことが鉄則です。
- Q3. 継代の際、トリプシン処理をしても細胞がなかなか剥がれません。
- PBS洗浄が不十分で血清が残っているか、細胞が過密になりすぎている可能性があります。洗浄を丁寧に行うか、トリプシンの濃度や処理温度(37℃)を見直してみてください。
- Q4. インキュベーターの水盤には何の水を入れるべきですか?
- 必ず滅菌蒸留水を使用してください。水道水は雑菌や不純物を含むためコンタミネーションの原因になります。また、防腐剤や硫酸銅を添加することで菌の繁殖を抑えることも有効です。
- Q5. ダブルリング(二重の輪)のようなものが見えますが、これは何ですか?
- 細胞が死んでいる、または死にかけている際に見られる形態変化の可能性があります。あるいは、ピントが合っていないだけのこともあります。生存率を確認し、必要であれば培地交換や継代を行ってください。