細胞培養において、技術者が最も恐れるトラブルの一つが「コンタミネーション(汚染)」ではないでしょうか。
大切に育ててきた細胞が廃棄になるだけでなく、汚染源の特定や除染作業に多くの時間を費やし、最悪の場合は製造ラインの停止や製品回収といった重大な事態を招きかねません。
特に再生医療分野においては、患者様の体内に直接投与される製品を取り扱うため、一般的な研究レベルよりも遥かに厳格な無菌性保証が求められます。
本記事では、再生医療の現場で求められるGMP/GCTP基準を意識した、実践的なコンタミネーション対策について解説します。
発生源の遮断から、環境管理、無菌操作の標準化、そして万が一トラブルが発生した際の対応手順まで、プロトコルの見直しや教育訓練に役立つ情報を網羅的にまとめました。
確実な培養結果と安全性を担保するために、ぜひ貴社の管理体制の再確認にお役立てください。
細胞培養のコンタミネーション対策は「発生源の遮断」と「厳格なプロセス管理」が結論
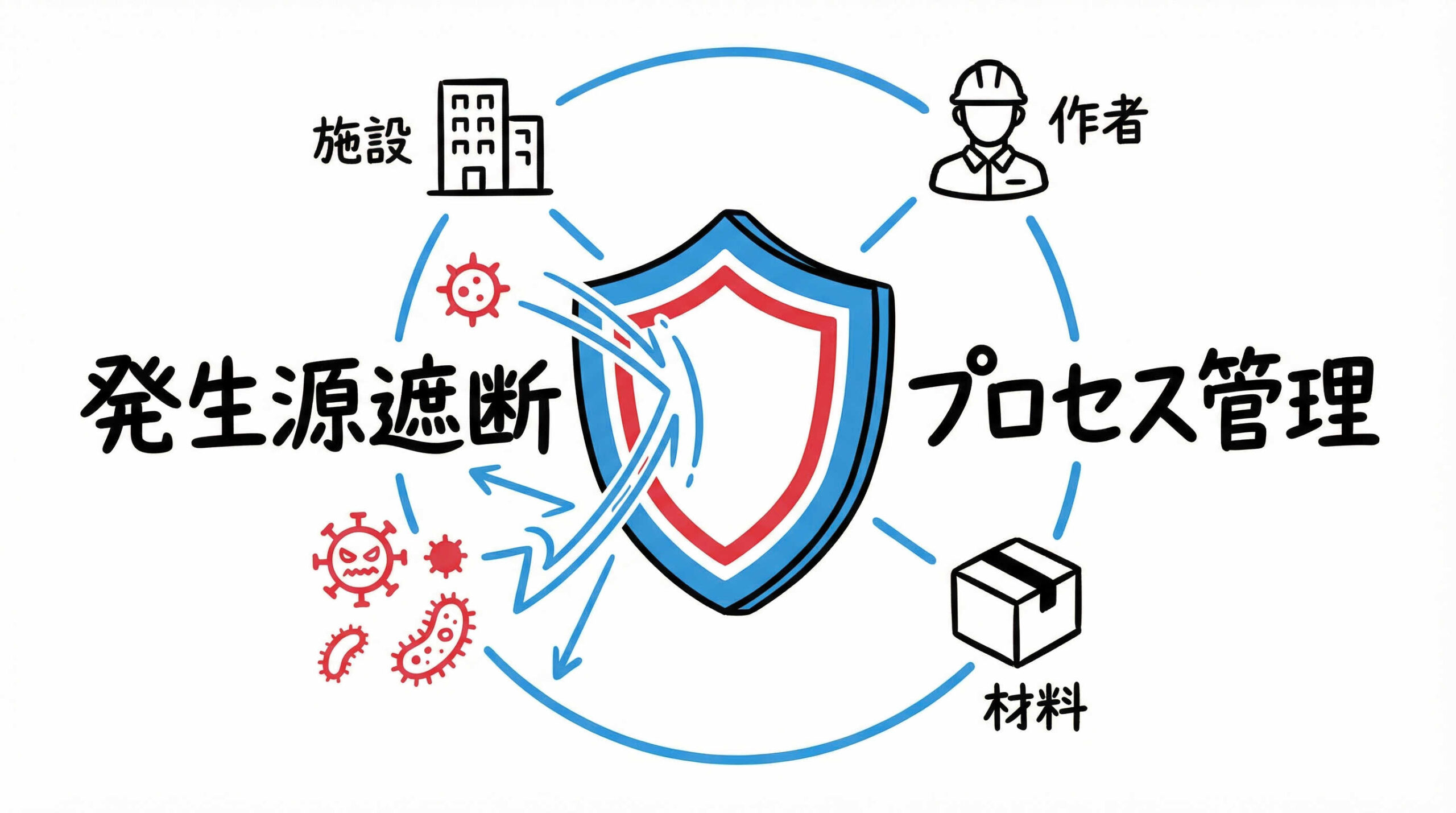
細胞培養におけるコンタミネーション対策の基本は、汚染物質を「持ち込まない」「発生させない」「広げない」ことに尽きます。
そのためには、特定の工程だけでなく、施設全体、作業者、使用する資材など、あらゆる要素を包括的に管理するシステムが必要です。
ここでは、対策の根幹となる考え方と、再生医療等の製品製造において遵守すべき基準について解説します。
無菌操作・環境管理・資材管理の3要素を統合的に管理する重要性
コンタミネーションを防ぐためには、単一の対策ではなく、「無菌操作(手技)」「環境管理(設備)」「資材管理(モノ)」の3つの要素を統合的に管理することが不可欠です。
- 無菌操作: 作業者による人為的な汚染を防ぐための手技の標準化と教育訓練
- 環境管理: 浮遊微粒子や微生物を制御した清浄な空間(CPFなど)の維持
- 資材管理: 培地や試薬、消耗品の無菌性保証と適切な保管
これらは相互に関連しており、どれか一つでも欠ければリスクは高まります。例えば、どんなに高度なクリーンルームを用意しても、作業者の手技が不適切であれば汚染は防げません。
3要素のバランスを保ち、リスクアセスメントに基づいた管理体制を構築することが重要です。
再生医療におけるGMP/GCTP基準に適合した無菌性保証の考え方
再生医療等製品の製造においては、GCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice)省令に基づいた厳格な品質管理が求められます。
研究室レベルでの「コンタミしなければ良い」という結果オーライの考え方ではなく、「無菌性が科学的に保証されたプロセスで製造されたか」というプロセス保証の観点が必要です。
具体的には、構造設備が適切に設計・維持管理されていること、標準作業手順書(SOP)が整備され遵守されていること、そしてそれらがバリデーションによって検証されていることが前提となります。
監査や査察においても、これらの記録類が適切に残されているかが重要な確認事項となりますので、日頃からの記録管理も対策の一環と捉えましょう。
コンタミネーションの主な種類と混入経路の特定
敵を知ることは対策の第一歩です。コンタミネーションの原因となる汚染物質には様々な種類があり、それぞれ混入経路や検出のしやすさが異なります。
ここでは、代表的な汚染の種類である細菌、真菌、マイコプラズマ、ウイルス、そして細胞間の交差汚染について、その特徴とリスクを整理します。
細菌・真菌(カビ)による汚染の特徴と目視での識別
細菌や真菌(カビ・酵母)は、最も頻繁に遭遇する汚染源です。
これらは増殖速度が速く、多くの場合、培養液の混濁やpH変化による変色(フェノールレッドが黄色くなる等)として目視で確認できます。
- 細菌: 培地が白く濁り、顕微鏡下では微細な粒子が振動しているように見えます。
- 真菌: 培地表面にコロニーを形成したり、顕微鏡下で菌糸が確認できたりします。
主な侵入経路は、作業者の手指、衣類、呼気、あるいはインキュベーター内の水盤や棚板などです。
目視で発見しやすいため初期対応は比較的容易ですが、胞子を形成するカビの場合は、施設全体に汚染が広がるリスクがあるため、迅速かつ慎重な対応が求められます。
マイコプラズマ汚染の検出難易度と細胞への影響
マイコプラズマは細胞壁を持たない非常に小さな細菌で、一般的な光学顕微鏡での観察や、培地の混濁による目視確認が困難な厄介な存在です。
汚染されても細胞がすぐに死滅することは少ないですが、細胞の代謝や遺伝子発現に影響を与え、実験データの信頼性を損なったり、細胞製剤としての品質規格を満たせなくなったりします。
主な汚染源は、既に汚染された細胞ストックの持ち込みや、作業者の飛沫、試薬類です。
目視での発見が難しいため、PCR法や蛍光染色法などを用いた定期的な検査ルーチンを確立することが、唯一の確実な対策となります。
ウイルス汚染のリスクとスクリーニングの必要性
ウイルスによる汚染は、細胞そのものへの影響だけでなく、製品を投与される患者様への安全性に直結する重大なリスクです。
ウイルスは光学顕微鏡では見えず、細胞変性効果(CPE)が現れない限り、通常の培養過程で気づくことはほぼ不可能です。
主な混入経路は、動物由来の原材料(血清やトリプシンなど)や、ヒト由来の細胞そのものです。
対策としては、ウイルスフリーが保証された原材料を使用すること、および製造工程におけるウイルスクリアランス試験や、最終製品のウイルス否定試験を実施することが不可欠です。
特に異種動物由来成分を使用する場合は、厳格なリスク評価が求められます。
細胞間のクロスコンタミネーション(交差汚染)
クロスコンタミネーション(交差汚染)とは、取り扱っている細胞に別の種類の細胞が混入し、取って代わられてしまう現象です。
例えば、増殖の速いHeLa細胞などが他の培養皿に混入すると、短期間で培養系全体がHeLa細胞に置き換わってしまう事例が過去に多数報告されています。
原因は、複数の細胞株を同時に安全キャビネット内で操作することや、培地ボトルの共用などが挙げられます。
これを防ぐためには、「1キャビネット・1細胞株」の原則を守り、細胞株ごとのSTR(Short Tandem Repeat)解析による認証試験を定期的に行うことが推奨されます。
【環境管理】清浄度を維持するための設備・機器対策
細胞加工施設(CPF)などのハードウェア面における管理は、無菌操作を支える基盤です。
適切な清浄度を維持するためには、空調システムから実験機器の細部に至るまで、計画的なメンテナンスとモニタリングが必要です。
ここでは、環境由来の汚染を防ぐための具体的な設備対策について解説します。
細胞加工施設(CPF)の室圧管理と清掃・消毒プログラム
CPFの清浄度を維持するためには、外部からの汚染物質の侵入を防ぐ「室圧管理」が重要です。
清潔区域を陽圧(プラスの圧力)に保ち、空気が常に「清潔区域 → 準清潔区域 → 汚染区域」へと流れるように制御します。差圧計の数値を日常的に記録し、異常がないか監視しましょう。
また、清掃・消毒プログラムの策定も欠かせません。
- 日常清掃: 作業前後の床や表面の拭き取り
- 定期清掃: 壁面や天井、機器の裏側などを含めた大掃除
これらをSOP化し、使用する消毒剤(アルコール、次亜塩素酸ナトリウムなど)も定期的にローテーションすることで、耐性菌の出現を抑制する効果も期待できます。
安全キャビネット(BSC)の気流確保と定期バリデーション
安全キャビネット(BSC)は、無菌操作の要となる機器です。
HEPAフィルターを通した清浄な空気が層流となって流れることで、内部を無菌に保ちつつ、作業者への曝露も防ぎます。
この性能を維持するためには、前面のシャッター開度を適切に保ち、吸気グリル(エアカーテン)を物品や腕で塞がないことが鉄則です。
また、年1回の定期バリデーション(定期点検)は必須です。
風速、風量、フィルターのリーク(漏れ)、気流の方向などを専門業者に測定してもらい、規格を満たしていることを確認してください。性能が低下したBSCでの作業は、コンタミの最大のリスク要因となります。
インキュベーター内の加湿水・棚板の汚染防止策
インキュベーター(培養器)内は、細胞にとって最適な環境であると同時に、微生物にとっても増殖しやすい高温多湿な環境です。
特に加湿用の水盤(ウォーターパン)はカビや細菌の温床になりやすいため、注意が必要です。
- 加湿水: 滅菌水を使用し、週に1回程度は全交換する。防腐剤の使用は細胞への影響を考慮して慎重に行う。
- 棚板・庫内: 定期的に取り外してオートクレーブ滅菌するか、アルコール等で清拭消毒する。
銅製の棚板や内壁を持つインキュベーターは抗菌作用が期待できますが、過信せず定期的な清掃を行うことが重要です。
環境モニタリングによる浮遊菌・落下菌・表面付着菌の監視
目に見えない環境の汚れを可視化するために、環境モニタリングを実施します。
これにより、清浄度が維持されているかを客観的なデータとして把握できます。
- 浮遊菌: エアーサンプラーで空気を吸引し、浮遊する菌を測定
- 落下菌: 寒天培地を開放状態で一定時間放置し、落下してくる菌を測定
- 表面付着菌: スタンプ培地で床や壁、機器表面の菌を採取
これらの測定結果に対して「アラートレベル(警戒値)」と「アクションレベル(処置値)」を設定し、基準を超えた場合には直ちに原因究明と是正措置(清掃強化など)を行える体制を整えておくことが、GMP管理では求められます。
【無菌操作】人為的汚染を防ぐ手技の標準化(SOP)
設備が整っていても、そこで作業する「人」が汚染源となっては意味がありません。実際、コンタミネーションの原因の多くは人為的なミスや不適切な手技に起因します。
誰が作業しても同じ品質を保てるよう、手技を標準化(SOP化)し、徹底することが重要です。
ここでは、無菌操作における具体的なポイントについて解説します。
適切なガウンニング(更衣)手順と手洗い・手指消毒の徹底
人は最大の発塵源であり、皮膚や毛髪には多くの常在菌が存在します。これらをクリーンルーム内に持ち込まないために、適切なガウンニング(更衣)手順の遵守が不可欠です。
無菌衣は、床につかないように着用し、手首や首元からの皮膚の露出を最小限に抑えます。
手洗いと手指消毒も極めて重要です。
作業前には肘まで入念に手洗いを行い、BSCに手を入れる直前には必ず消毒用エタノールで手袋を消毒します。
手袋をしていても、無意識に顔や髪、椅子などに触れてしまった場合は、直ちに消毒し直すか手袋を交換する習慣をつけましょう。
安全キャビネット内での作業動線と物品配置のルール
安全キャビネット内での作業は、清潔な空気が流れる方向を意識した物品配置と動線が重要です。
基本は「清潔区域」から「汚染区域」への一方通行の動線を守ることです。
- 清潔側(上流): 滅菌済みのピペット、培地ボトルなど
- 汚染側(下流): 廃液タンク、使用済みチップなど
- 中央: 作業スペース
手や物が頻繁に交差するような配置は避けましょう。また、BSC内に物を詰め込みすぎると気流が乱れ、汚染のリスクが高まります。必要なものだけを最小限持ち込むことが原則です。
ピペッティング操作によるエアロゾル拡散の防止テクニック
ピペッティング操作は、目に見えない微細な飛沫(エアロゾル)を発生させる原因となり得ます。
エアロゾルに乗って菌が拡散したり、クロスコンタミを引き起こしたりするのを防ぐため、以下のテクニックを習得しましょう。
- ゆっくり操作: 急激な吸引・吐出は避け、静かに行う。
- 泡立てない: 泡が弾ける際にエアロゾルが発生するため、泡立てないように注意する。
- 角度: ピペットを培地ボトルに挿入する際、ピペット本体がボトルの口に触れないよう、適切な角度と距離を保つ。
綿栓付きのピペットを使用することも、ピペット内部への汚染防止に有効です。
培地交換・継代作業時における検体取り違え防止策
複数の検体を同時に扱う場合、取り違えやクロスコンタミのリスクが格段に上がります。
これを防ぐための鉄則は、「一度に一検体のみ」BSC内に持ち込むことです。
どうしても複数検体を扱う必要がある場合は、ボトルやディッシュに明確なラベリングを行い、配置場所を明確に区切るなどの工夫が必要です。
また、培地交換や継代作業の合間には、こまめに手袋の消毒を行うか、検体ごとに手袋を交換することを推奨します。
単純なミスを防ぐための物理的な制約や確認プロセスをSOPに組み込むことが、安全性を高めます。
【品質管理】試薬・資材からの持ち込みリスク低減
使用する培地、試薬、プラスチック消耗品などが既に汚染されていれば、どんなに無菌操作を徹底してもコンタミネーションは避けられません。
外部から購入する資材の品質を管理し、使用時までの保管状況を適切にコントロールすることも重要な対策の一つです。
ここでは、資材由来のリスクを低減するための管理ポイントを解説します。
培地・試薬の受入試験と使用期限・保管状況の管理
培地や試薬を購入する際は、メーカーが発行する試験成績書(CoA: Certificate of Analysis)を確認し、無菌試験やマイコプラズマ否定試験、エンドトキシン試験などが規格適合しているかを確認します。
納品時には、外箱の破損や水濡れがないかを目視でチェックし、汚染の疑いがあるものは受け入れない勇気も必要です。
また、使用期限の管理を徹底し、開封後は使用期限内であっても早めに使い切るようにします。
保管温度の逸脱は成分の劣化だけでなく、微生物の増殖を許す可能性があるため、温度ロガー等での監視が望ましいでしょう。
滅菌済みプラスチック消耗品の包装開封時・保管時の注意点
滅菌済みのフラスコやピペットなどの消耗品は、包装を開封する瞬間が最も汚染リスクの高いタイミングです。
開封は必ず安全キャビネット(BSC)内で行うのが原則です。
BSCに持ち込む前には、包装の外側をアルコールを含ませたワイパーで清拭し、付着している塵埃を除去します。
また、大袋を開封して残りを保管する場合は、テープ等で確実に封をし、清潔な保管庫で管理します。
袋の口が開いたまま放置することは、落下菌による汚染を招くため厳禁です。
凍結細胞ストックの管理と定期的なマイコプラズマ検査
細胞ストックは資産そのものですが、これらが汚染源となるケースも少なくありません。
外部から細胞を導入した際や、自社でセルバンクを作製した際には、必ずマイコプラズマ検査を実施し、陰性を確認してから使用または保管するルールを設けましょう。
凍結保存タンク(液体窒素タンク)内での汚染拡大を防ぐため、気相保存を採用するか、液相保存の場合はアンプルからの液漏れがないよう完全に密封されていることを確認します。
定期的に一部のストックを解凍して品質検査を行うことも、長期的な安定性を保つために有効です。
予防的な抗生物質使用の是非と耐性菌リスクへの理解
「念のため」と日常的に培地に抗生物質を添加しているケースが見受けられますが、これは推奨されません。
抗生物質の使用は、不適切な無菌操作を隠蔽してしまう(マイコプラズマなどの汚染に気づきにくくなる)だけでなく、耐性菌の出現リスクを高めます。
また、再生医療等製品として細胞を使用する場合、最終製品に抗生物質が残留することは安全性(アレルギー反応など)の観点から望ましくありません。
原則として抗生物質に頼らない培養系を確立し、技術力と環境管理で無菌性を維持することが、プロフェッショナルな品質管理と言えます。
コンタミネーション発生時のトラブルシューティング手順
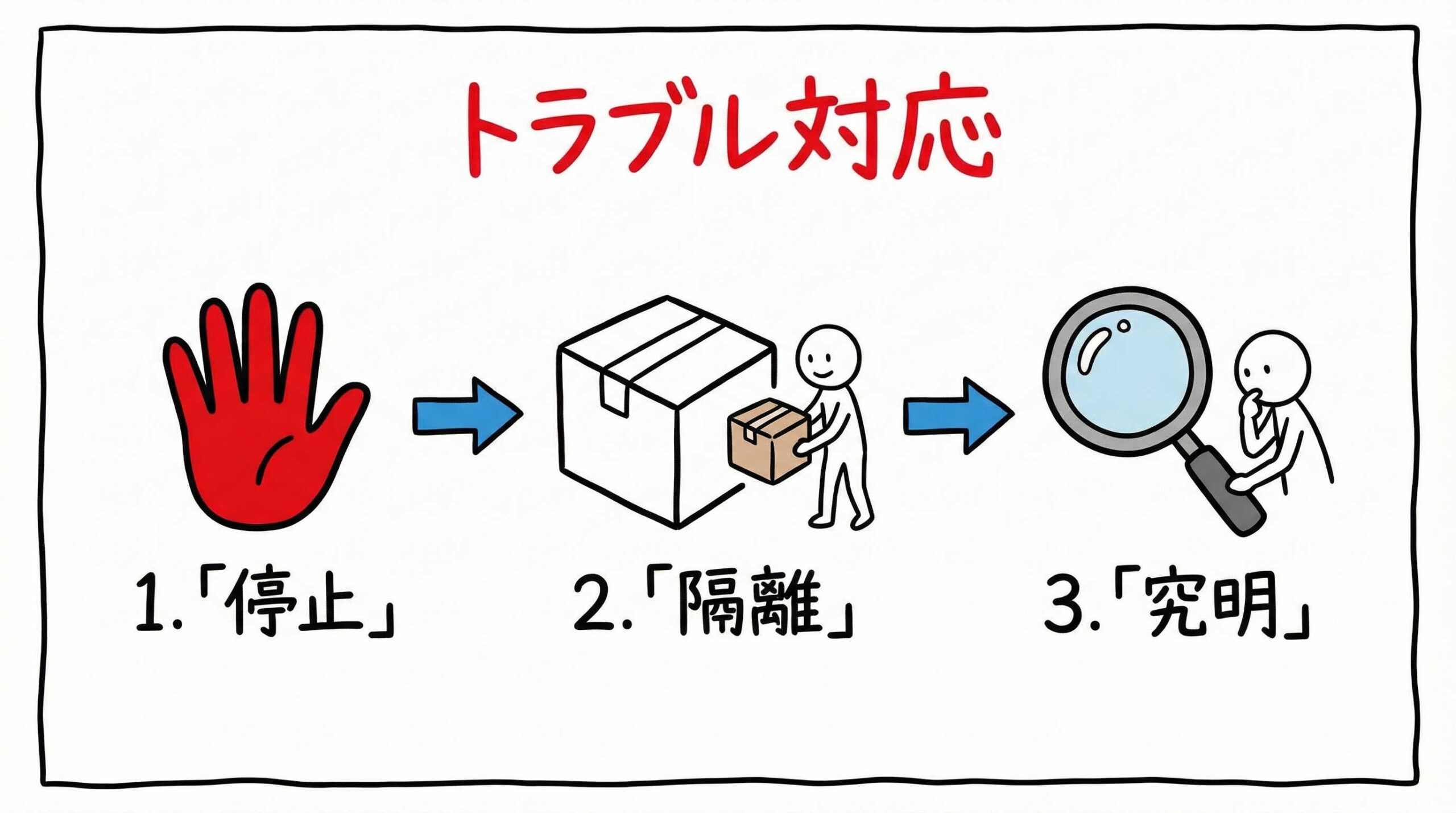
万全の対策をしていても、コンタミネーションが発生する可能性をゼロにすることは困難です。
重要なのは、発生時にパニックにならず、定められた手順に従って迅速に対応し、被害を最小限に食い止めることです。
ここでは、コンタミ疑いが生じた際の初期対応から、原因究明、再発防止までのフローを解説します。
コンタミ疑い発生時の初期対応と汚染拡大防止措置
培養液の濁りや異変に気づいたら、直ちにその培養容器の操作を中止し、他の正常な細胞から隔離します。
疑わしい容器は密閉し、可能であれば専用の隔離インキュベーターへ移動させるか、ビニール袋に入れて密封します。
同時に、同じインキュベーターに入っていた他の細胞や、同じ培地を使用した他のバッチにも影響が及んでいないかを確認します。
被害拡大を防ぐため、汚染が確定するまでは、その培養室やBSCの使用を制限する(立ち入り禁止や使用中止の表示を行う)措置をとることも検討してください。
顕微鏡観察と培養検査による汚染源の同定プロセス
次に、何が原因で汚染が起きたのかを特定します。
まずは位相差顕微鏡で汚染微生物の形態(球菌、桿菌、真菌の菌糸など)を観察します。
必要に応じて、グラム染色や簡易同定キットを使用したり、外部の検査機関に同定検査を依頼したりして、菌種を特定します。
菌種が特定できれば、「人の皮膚由来(ブドウ球菌など)」「環境由来(カビ、枯草菌など)」「水由来」といった汚染ルートの推定が可能になり、的確な対策を打つことができます。
原因不明のまま廃棄してしまうと、再発を防ぐことができません。
汚染された培養器・エリアの除染・滅菌プロトコル
汚染源が特定されたら、除染作業を行います。
汚染された培養物は、オートクレーブ滅菌してから廃棄します。培地をシンクにそのまま流すことは絶対に避けてください。
汚染が発生したインキュベーターや安全キャビネットは、徹底的に清掃・消毒します。
取り外し可能なパーツはオートクレーブし、庫内は消毒用エタノールや適切な除染剤で清拭します。
汚染が深刻な場合や広範囲に及ぶ場合は、ホルムアルデヒドや過酸化水素による燻蒸(くんじょう)滅菌が必要になることもあります。
除染後は、環境モニタリングを行い、清浄度が回復したことを確認してから使用を再開します。
原因究明に基づく是正措置・予防措置(CAPA)の実施
トラブル対応の締めくくりは、是正措置・予防措置(CAPA: Corrective Action and Preventive Action)です。
「なぜ汚染が起きたのか」を根本原因まで掘り下げ(Why-Why分析など)、SOPの不備、教育不足、設備の不具合などの真因を特定します。
その上で、SOPの改訂や再教育の実施といった再発防止策を策定・実行し、その効果を検証します。
この一連のプロセスを記録として残すことが、GMP/GCTP管理においては極めて重要であり、組織全体の品質管理レベルを向上させる機会となります。
まとめ
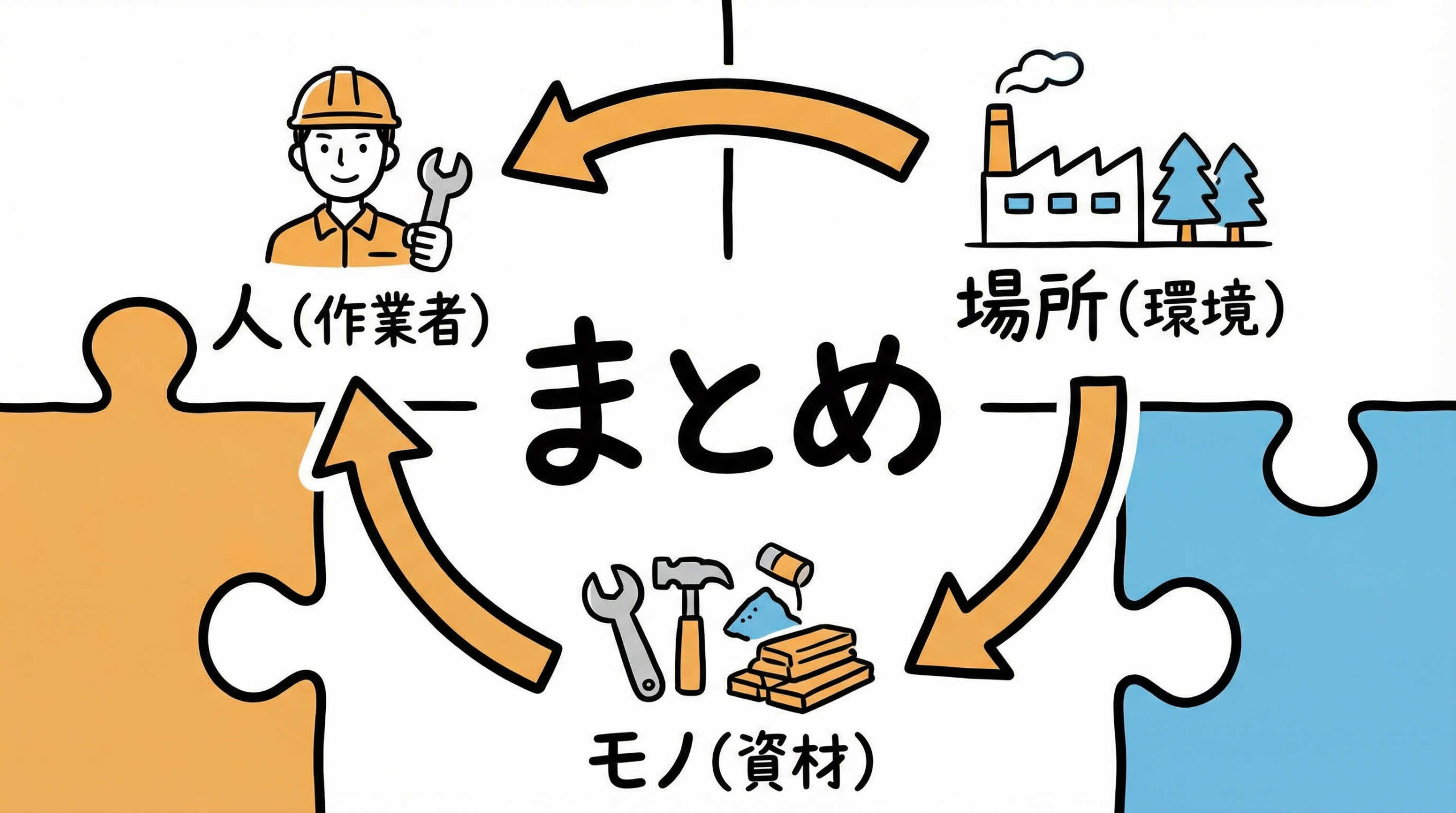
細胞培養におけるコンタミネーション対策について、発生源の遮断から具体的な管理手法、トラブル時の対応まで解説しました。
対策の要点は以下の通りです。
- 3要素の統合管理: 無菌操作(人)、環境管理(場所)、資材管理(モノ)をバランスよく管理する。
- プロセスの標準化: SOPを整備し、誰が作業しても同じ品質を保てるようにする。
- 早期発見と迅速対応: 日々の観察とモニタリングを怠らず、異常時は直ちに隔離・原因究明を行う。
- 継続的な改善: トラブルを学びに変え、CAPAを通じて管理体制を強化し続ける。
コンタミネーション対策に「これで完璧」というゴールはありません。
日々の地道な管理と、スタッフ一人ひとりの高い意識こそが、貴重な細胞を守り、患者様に安全な製品を届けるための最強の防壁となります。
本記事を参考に、ぜひ貴社の培養現場のプロトコルを今一度見直してみてください。
細胞培養におけるコンタミネーション対策についてよくある質問

細胞培養の現場で頻繁に寄せられる質問とその回答をまとめました。
日々の業務やSOPの見直しにお役立てください。
- Q1. 抗生物質(抗菌剤)を使用せずに培養することは可能ですか?
- はい、可能です。むしろ再生医療等の製品製造では、耐性菌の出現リスクや製品への残留リスクを避けるため、抗生物質不使用(Antibiotic-free)での培養が推奨されます。徹底した無菌操作と環境管理があれば、抗生物質なしでもコンタミを防ぐことは十分可能です。
- Q2. インキュベーター内の水交換はどのくらいの頻度で行うべきですか?
- 一般的には週に1回程度の全交換が推奨されます。使用する水は必ず滅菌水を用い、水盤(ウォーターパン)もその都度清掃・消毒してください。汚れが目立つ場合や、カビが発生しやすい環境では、より頻繁な交換が必要です。
- Q3. マイコプラズマ検査はどのタイミングで実施すべきですか?
- 新しい細胞株を受け入れた時、セルバンクを作製した時、および培養終了時(製品出荷前)の実施が基本です。長期培養を行う場合は、1ヶ月に1回などの定期的なスクリーニング検査を組み込むことをお勧めします。
- Q4. 培地が濁っていませんが、コンタミネーションの可能性はありますか?
- はい、あります。特にマイコプラズマやウイルス、一部の真菌は、培地の混濁を引き起こさないことがあります。細胞の増殖速度が低下した、形態がおかしい、剥がれやすくなった等の変化が見られた場合は、コンタミを疑い検査を行ってください。
- Q5. 安全キャビネット(BSC)の清掃にUVランプ照射だけで十分ですか?
- いいえ、不十分です。UV(紫外線)は影になる部分には効果がなく、透過力も弱いため、表面の汚れの奥まで届きません。作業前後には必ずアルコール等を用いた物理的な清拭消毒(拭き取り)を行う必要があります。UV照射はあくまで補助的な手段と考えてください。