再生医療等製品の実用化が進む中、研究開発段階から商用生産フェーズへの移行において、多くの企業が製造プロセスの「スケールアップ」という大きな壁に直面しています。ラボレベルの手作業による培養から、効率的かつ安定した大量生産体制へ移行するためには、早期の戦略立案が欠かせません。本記事では、再生医療の現場で求められる細胞培養のスケールアップ戦略について、具体的な手法や注意点を交えて詳しく解説します。商用化を見据えた製造プロセスの最適化にお役立てください。
細胞培養のスケールアップ戦略の結論:商用化に向けた3次元培養と自動化の導入
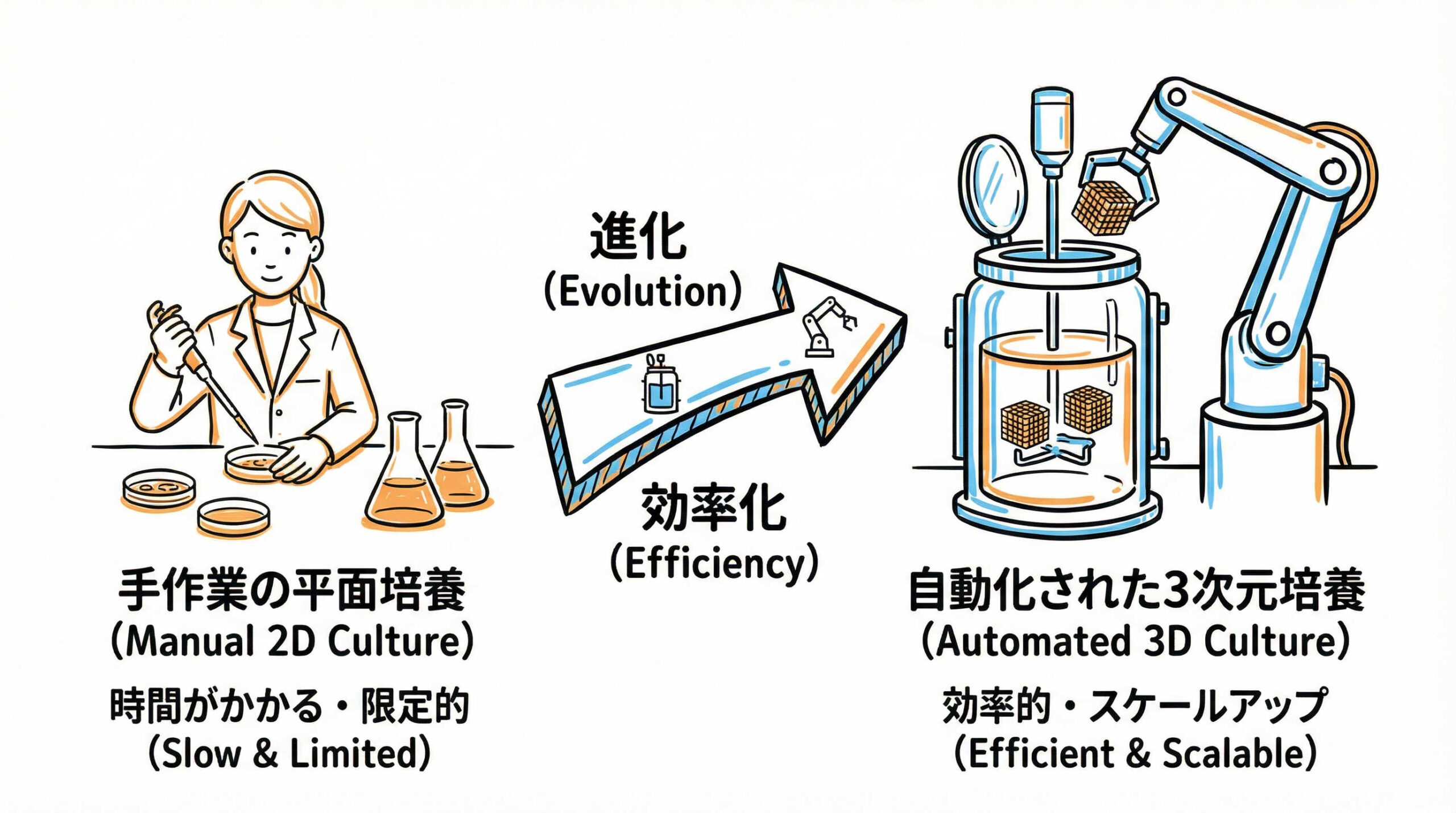
結論から申し上げますと、再生医療製品の商用化を成功させるためのスケールアップ戦略において、最も重要な鍵は「3次元培養(浮遊培養)技術への移行」と「プロセスの自動化・閉鎖系化」にあります。
従来の手作業による平面培養(2D培養)では、数千億個単位の細胞を製造するために膨大なスペースと人手が必要となり、コストと品質管理の両面で限界が生じます。これに対し、バイオリアクターを用いた3次元培養は、単位体積あたりの生産効率を飛躍的に高めることが可能です。さらに、自動培養装置やシングルユース技術を組み合わせることで、人為的ミスを排除し、GMP(Good Manufacturing Practice)が求める高度な品質保証体制を構築できます。
つまり、製造原価(CoG)を抑えつつ、高品質な製品を安定供給するためには、早期にラボスケールの手法から脱却し、スケーラビリティのある製造プロセスへと転換することが必須の戦略となるでしょう。
再生医療製品の製造におけるスケールアップの必要性と課題
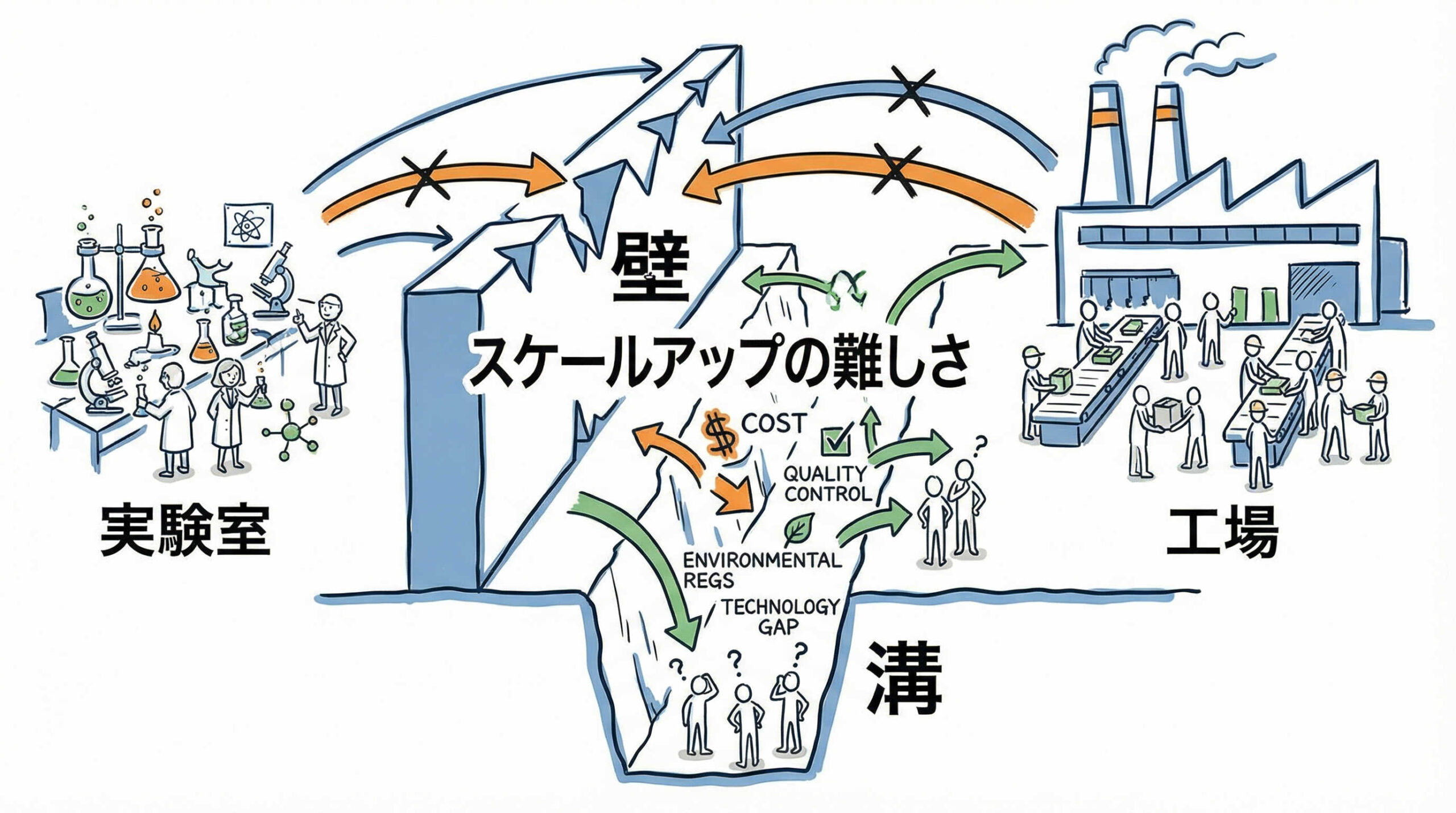
再生医療製品を社会に広く普及させるためには、安定的な大量生産技術の確立が避けて通れません。しかし、研究室での小規模な実験と、患者様へ届けるための商用生産とでは、求められる要件が大きく異なります。ここでは、スケールアップが必要とされる背景と、その過程で直面する主な課題について整理しましょう。
ラボスケールから商用生産への移行に伴うギャップ
アカデミアや初期の研究開発段階では、シャーレやフラスコを用いた手技中心の培養が行われることが一般的です。しかし、これをそのまま商用生産へ移行しようとすると、製造能力と品質管理のギャップに苦しむことになります。
数人分の治験薬製造であれば手作業でも対応可能かもしれませんが、数百人、数千人規模の需要に応えるには、プロセスの堅牢性が足りません。ラボスケールで確立された条件が、そのまま大規模スケールで再現できるとは限らないため、スケールアップを見越したプロセス開発(PD)が初期段階から求められます。
平面培養(2D)における作業量とスペースの限界
接着依存性細胞を従来の多層フラスコなどで培養する場合、必要な細胞数を得るために数百から数千枚ものフラスコを操作しなければならないケースがあります。これでは、培養室のスペースがいくらあっても足りませんし、操作する人員の確保も困難です。
また、開放系での操作回数が増えれば増えるほど、コンタミネーション(汚染)のリスクも高まります。物理的な作業量とスペースの制約は、平面培養におけるスケールアップの最大のボトルネックといえるでしょう。したがって、空間生産性を高めるための技術転換が必要不可欠です。
製造原価(CoG)の削減と経済合理性の追求
再生医療製品の普及を妨げる要因の一つに、高額な薬価が挙げられます。産業化においては、製造原価(CoG:Cost of Goods)の削減が重要な経営課題です。
人件費、培地コスト、品質管理コスト、そして設備維持費。これらを最適化するためには、労働集約的なプロセスから脱却し、効率的な生産体制を築く必要があります。スケールアップによって1バッチあたりの生産量を増やし、スケールメリットを享受することは、製品の経済合理性を高め、事業の持続可能性を確保するために極めて重要な視点です。
GMP製造に求められる品質の均一性と再現性確保
商用生産では、いつ、誰が製造しても同じ品質の製品ができること、すなわち「堅牢性」と「再現性」が厳しく問われます。手作業に依存したプロセスでは、作業者ごとの手技のバラつき(個人差)が製品品質の不均一性を招く恐れがあります。
GMP準拠の製造においては、製造パラメータを厳密に管理し、ロット間差を最小限に抑えなければなりません。スケールアップ技術の導入は、単に量を増やすだけでなく、機械化や自動制御によってプロセスの変動要因を減らし、品質を安定させるための手段でもあるのです。
スケールアウトとスケールアップの違いと適切な使い分け
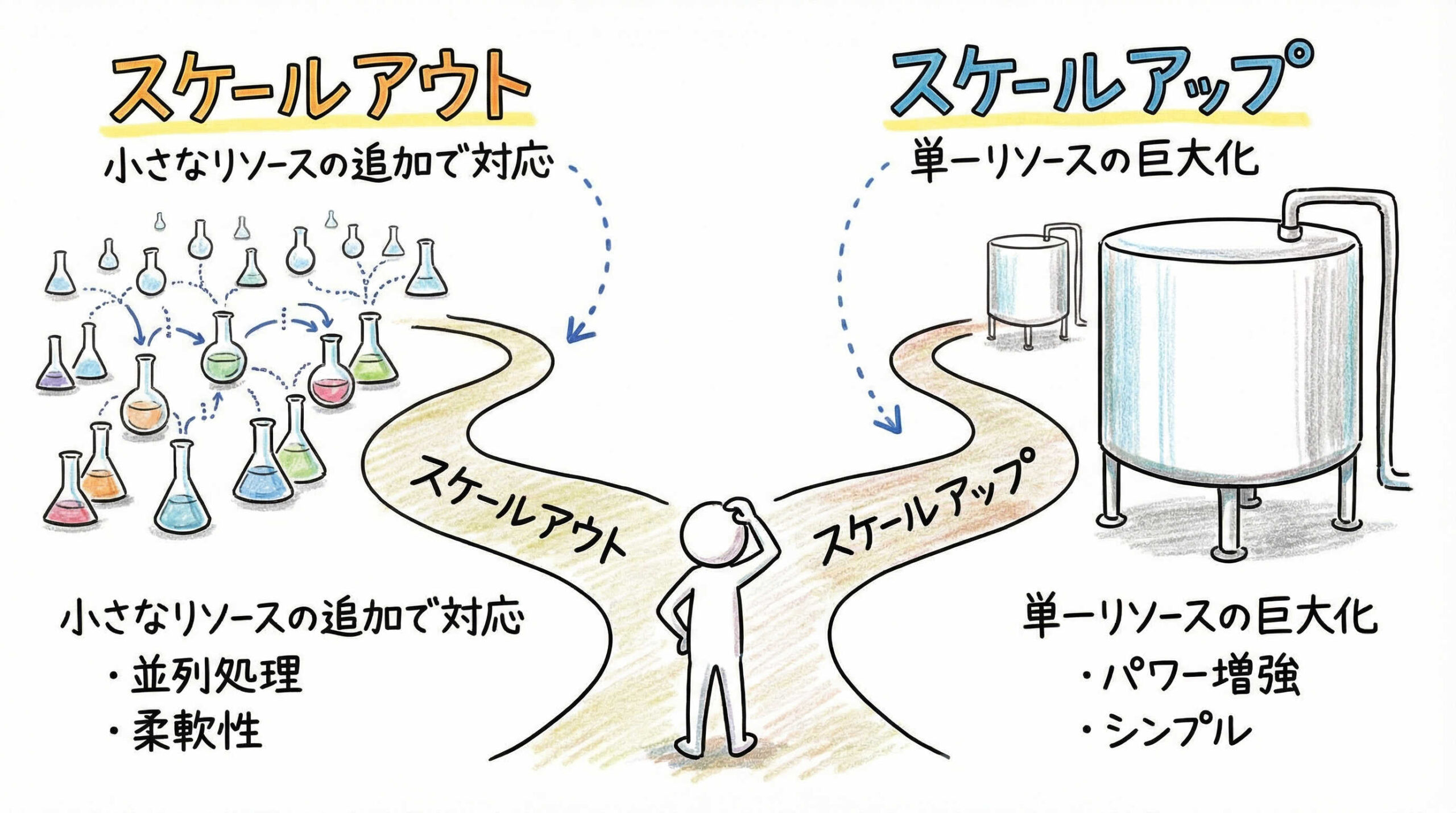
生産能力を増強するためのアプローチには、大きく分けて「スケールアウト」と「スケールアップ」の2つの方向性があります。これらは製造する製品の特性(自家か他家か)や細胞の種類によって使い分ける必要があります。それぞれの特徴を理解し、自社のプロジェクトに最適な戦略を選択しましょう。
スケールアウト(ナンバリングアップ)の特徴とメリット・デメリット
スケールアウトとは、培養容器のサイズは変えずに、容器の数や製造ラインの数を増やすことで生産能力を高める手法です。「ナンバリングアップ」とも呼ばれます。
メリット:
- 条件検討が比較的容易(ラボスケールの条件をそのまま適用可能)
- 1つのラインでトラブルが起きても、他のラインへの影響を限定できる(リスク分散)
デメリット:
- 設備投資やスペース、人件費が生産量に比例して増大する
- ロット管理が煩雑になる
患者様ご自身の細胞を用いる「自家移植(オートロガス)」の場合、患者ごとに製造ラインを分ける必要があるため、このスケールアウト戦略が基本となります。
スケールアップ(容積増大)の特徴とメリット・デメリット
スケールアップとは、培養装置(バイオリアクターなど)の容量そのものを大きくすることで、1バッチあたりの生産量を増やす手法です。
メリット:
- 生産量あたりのコスト(人件費、品質管理費)を大幅に削減できる
- 均一な品質の製品を大量に製造できる(ロット内均一性)
デメリット:
- 大型化に伴う物理環境の変化(混合効率、せん断力など)により、再度の条件検討が必要
- 1バッチ失敗時の損失が大きい
健康なドナーの細胞を大量に培養して多くの患者様に投与する「他家移植(アロジェニック)」では、コスト効率の観点からこのスケールアップ戦略が推奨されます。
対象細胞と目標生産量に応じた最適な戦略の選定基準
どちらの戦略を採用すべきかは、以下の要素を総合的に判断して決定します。
- 最終製品の形態: 自家移植(個別製造)か、他家移植(大量製造)か。
- 目標生産量: 年間で必要な細胞数はどの程度か。
- 細胞の特性: 接着依存性が強いか、浮遊培養が可能か。
例えば、他家由来のMSC(間葉系幹細胞)やiPS細胞由来製品のように、均質な製品を大量に供給する必要がある場合は、可能な限りバイオリアクターによる「スケールアップ」を目指すべきです。一方、希少疾患向けの自家CAR-T療法などでは、閉鎖系自動培養装置を並列化する「スケールアウト」が現実的な解となるでしょう。
接着培養から浮遊培養(3次元培養)への移行プロセス
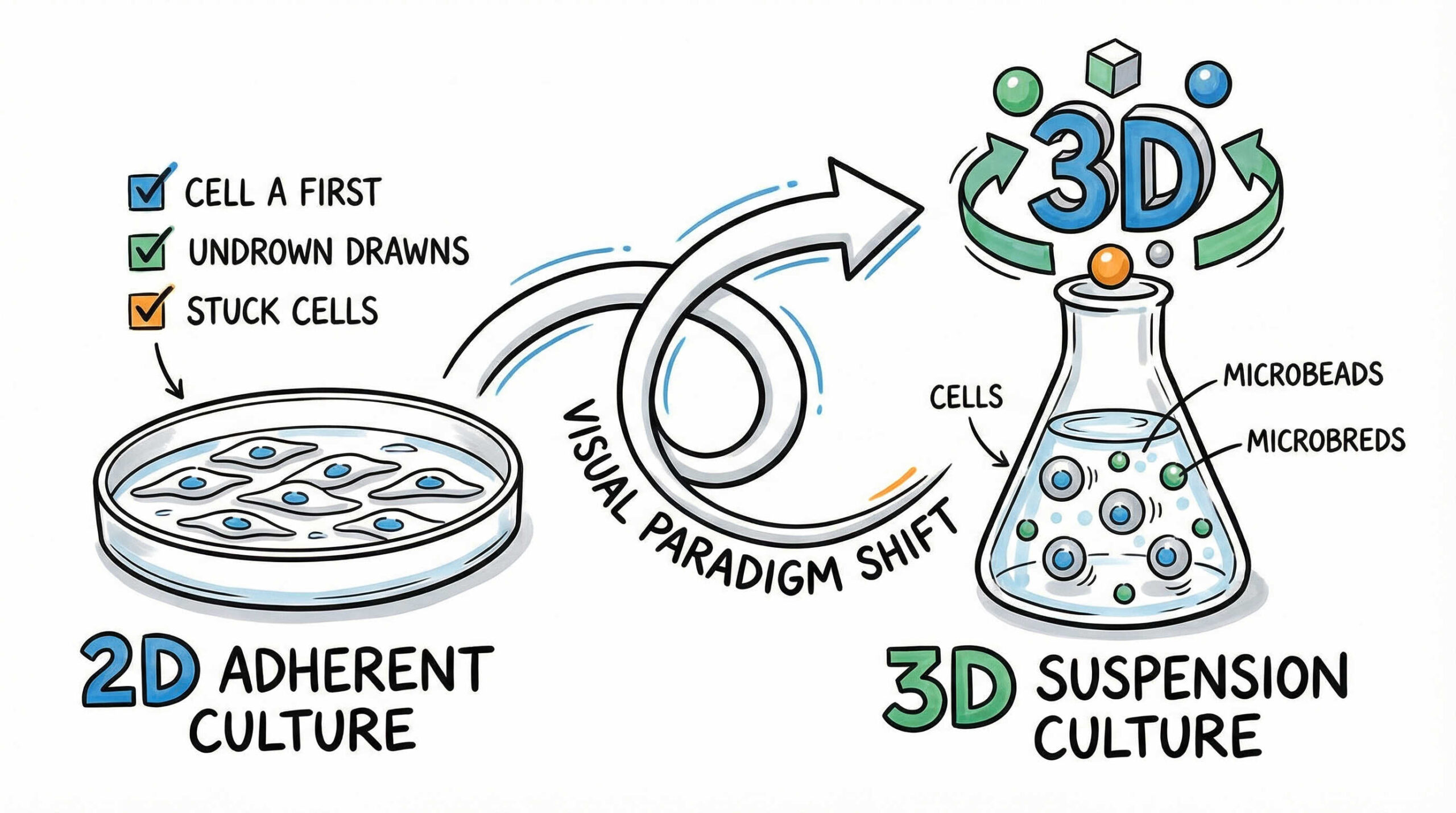
多くの細胞、特に間葉系幹細胞(MSC)などは足場に接着して増殖する性質を持っています。これらを大量培養するためには、平面(2D)から立体(3次元)への発想の転換が必要です。ここでは、接着細胞を効率的に増やすための3つの主要なアプローチについて解説します。
マイクロキャリアを用いた擬似的な浮遊培養技術
マイクロキャリアとは、細胞が付着できる微小なビーズのことです。これをバイオリアクター内の培地に浮遊させ、その表面に細胞を接着させることで、擬似的な浮遊培養状態を作り出します。
この方法の最大の利点は、従来の接着培養の特性を維持したまま、表面積を劇的に拡大できる点です。足場依存性の強い細胞でも、比較的スムーズにスケールアップが可能となります。ただし、最終工程で細胞とビーズを分離する操作が必要となり、その回収効率や微粒子の残留リスク管理が課題となることがあります。
凝集塊(スフェロイド)形成による浮遊培養技術
細胞同士を凝集させ、スフェロイド(細胞塊)を形成させることで、足場材を使わずに浮遊培養を行う手法です。iPS細胞やES細胞の維持培養、および分化誘導プロセスでよく用いられます。
マイクロキャリアを使用しないため、異物の混入リスクがなく、回収工程もシンプルになるのがメリットです。一方で、スフェロイドが大きくなりすぎると内部に酸素や栄養が行き渡らず、壊死(ネクロシス)が起こる可能性があります。そのため、撹拌速度や培地組成を調整し、スフェロイドのサイズを適切に制御する技術が求められます。
細胞の浮遊順化による完全浮遊培養へのアプローチ
本来は接着性の細胞を、培地組成の工夫や遺伝子改変などにより、単一細胞(シングルセル)の状態で浮遊しながら増殖できるように順化させるアプローチです。CHO細胞などの抗体医薬品製造では一般的ですが、再生医療用細胞では難易度が高い技術です。
もし完全浮遊化に成功すれば、マイクロキャリアもスフェロイド制御も不要となり、最も効率的な拡大培養が可能となります。しかし、細胞の性質(形質)が変化してしまうリスクがあるため、元の細胞と同等の機能や安全性を維持しているか、厳格な同等性評価が必要となります。
バイオリアクターを活用した具体的なスケールアップ手法
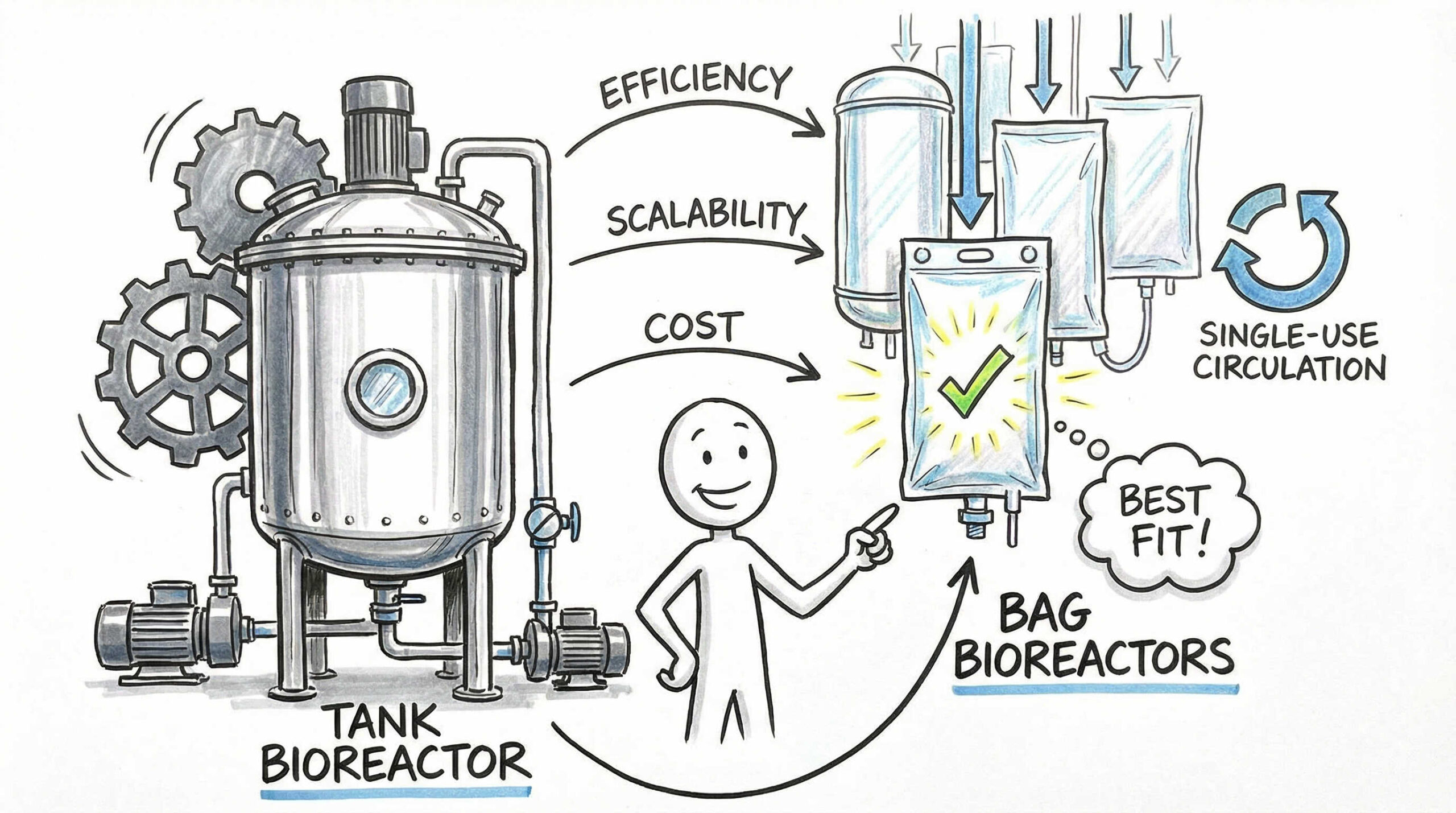
スケールアップを実現する上で、バイオリアクター(培養槽)の選定は極めて重要です。近年は再生医療特有のニーズに合わせた様々なタイプの装置が登場しています。それぞれの特性を理解し、自社の細胞やプロセスに最適な機器を選定することが成功への近道です。
コンタミネーションリスクを低減するシングルユース技術の活用
現在、再生医療の製造現場で主流となっているのが、プラスチック製の使い捨てバッグを使用する「シングルユース」のバイオリアクターです。
ステンレス製のタンクとは異なり、使用後の洗浄や滅菌(CIP/SIP)が不要なため、洗浄バリデーションの手間を大幅に削減できます。また、ロットごとの交差汚染(クロスコンタミネーション)のリスクを物理的に遮断できる点は、高い安全性が求められる再生医療において大きなメリットです。初期投資も比較的安価で、多品種少量生産にも柔軟に対応できるため、商用製造への移行期に最適です。
撹拌槽型(スターラータイプ)バイオリアクターの特徴
円筒形のタンク内でインペラ(撹拌翼)を回転させ、培地を撹拌する最も一般的なタイプです。抗体医薬品製造などで長い歴史があり、数リットルから数千リットルまでスケールアップの知見が豊富です。
培地中の酸素供給や均一性に優れていますが、回転する翼が細胞に物理的な衝撃(せん断力)を与える可能性があります。脆弱な細胞を培養する場合には、翼の形状を工夫したり、回転数を低く抑えたりといった繊細な制御が必要です。マイクロキャリア培養などで広く採用されています。
波及型(ロッキングタイプ)バイオリアクターの特徴
ピロー型のバッグを波打つように揺らすことで、培地を穏やかに混合するタイプです。表面積を広くとれるためガス交換効率が良く、撹拌翼がないため細胞へのせん断ストレスが非常に低いのが特徴です。
T細胞などの浮遊細胞の培養や、播種直後のデリケートな時期の培養に適しています。ただし、構造上、数百リットルを超えるような大規模なスケールアップには限界があるため、シードトレイン(種培養)の段階や、中規模スケールでの製造によく用いられます。
垂直ホイール型など低せん断力リアクターの検討
近年注目されているのが、垂直方向に回転するホイール型の撹拌機構を持つバイオリアクターです。従来の水平方向の撹拌とは異なり、より均一な粒子の浮遊状態を作り出しつつ、せん断力を低く抑えることができます。
特にiPS細胞のスフェロイド培養や、MSCのマイクロキャリア培養において、細胞へのダメージを最小限にしながら効率的な増殖を実現できると評価されています。スケールアップ時の流体解析(CFD)データも充実してきており、高品質な細胞製造の有力な選択肢となっています。
スケールアップ時の重要品質特性(CQA)と重要工程パラメータ(CPP)の管理

スケールアップを行う際、単に容器を大きくすれば良いというわけではありません。細胞にかかるストレスや環境の変化を最小限に抑え、品質を維持するためには、科学的な根拠に基づいたパラメータ管理が不可欠です。ここでは、特に注意すべき管理項目について解説します。
撹拌翼によるせん断力(Shear Stress)の制御
バイオリアクター内では、撹拌によって生じる水流や乱流が細胞に物理的な力(せん断力)を加えます。細胞はこれに敏感で、過度なストレスは増殖阻害や意図しない分化、あるいは細胞死を引き起こす原因となります。
スケールアップの際は、槽のサイズが変わっても細胞が受けるダメージが変わらないよう、撹拌先端速度や体積あたりの動力(P/V値)を指標として計算し、撹拌条件を最適化する必要があります。特にマイクロキャリア培養では、キャリア同士の衝突によるダメージも考慮しなければなりません。
槽内における溶存酸素(DO)とpHの均一性確保
大型のタンクになると、場所によって酸素濃度やpHにムラが生じやすくなります。例えば、酸素供給口の近くは高濃度でも、遠い場所では酸素不足(低酸素)になるといった事態です。
これを防ぐためには、適切な混合時間の確保と、高精度なセンサーによるモニタリングが重要です。pHや溶存酸素(DO)を一定に保つためのフィードバック制御(ガス流量やアルカリ添加の調整)を精密に行い、槽内全体の環境を均一に保つことが、細胞の品質安定化に直結します。
培地交換効率と代謝産物(乳酸・アンモニア)の除去
高密度培養を行うと、細胞が排出する乳酸やアンモニアといった老廃物が培地中に蓄積し、細胞毒性を示します。これらを効率的に除去し、新鮮な栄養を供給する戦略が必要です。
単純なバッチ培養(回分培養)では限界があるため、フィードバッチ(流加培養)や、連続的に培地を交換するパフュージョン(灌流培養)技術の導入が効果的です。特に灌流培養は、一定の培養環境を維持しやすく、高密度培養におけるスケールアップ戦略として非常に有効です。
スケール変更前後における細胞の同等性/同質性評価
最も重要なのは、スケールアップ前後で「細胞が変わっていないこと」を確認することです。これを同等性(Comparability)評価と呼びます。
細胞表面マーカーの発現パターン、生存率、増殖能といった基本的な特性に加え、分化能や分泌因子のプロファイル、遺伝子発現解析、さらには造腫瘍性の有無など、多角的な評価が必要です。プロセス変更が製品の安全性や有効性に影響を与えていないことを科学的に証明できて初めて、そのスケールアップ戦略は成功したと言えるのです。
自動培養装置導入による製造プロセスの安定化と省人化
スケールアップと並んで重要なのが、製造プロセスの自動化です。人の手による操作を減らすことは、コスト削減だけでなく、規制当局が求めるデータの完全性(Data Integrity)や品質保証の観点からも強力な武器となります。
手技のバラつきを排除する自動化のメリット
熟練した技術者であっても、日々の体調や微細な操作の違いによって培養結果にバラつきが生じることがあります。自動培養装置を導入することで、ピペッティングの速度や撹拌のタイミングなどをプログラム通りに正確に実行でき、この「人による変動」をほぼゼロにできます。
また、閉鎖系での自動化は無菌操作区域(グレードA/B)での作業時間を減らし、更衣や環境モニタリングにかかるコストも削減します。結果として、製造の失敗率を下げ、歩留まりを向上させることに繋がります。
インラインモニタリングによるリアルタイム工程管理(PAT)
従来の培養では、毎日サンプリングを行い、オフラインで細胞数や代謝物を測定していました。しかし、これでは測定結果が出るまでにタイムラグがあり、異常への対応が遅れることがあります。
自動化装置にインラインセンサーを組み込み、リアルタイムで培養状況を監視するPAT(Process Analytical Technology)を導入すれば、プロセスの変動を即座に検知し、自動補正することが可能です。これは「品質を工程の中で作り込む(QbD)」という現代のGMPの考え方に合致します。
ダウンストリーム工程(分離・精製)との連携
培養(アップストリーム)が自動化されても、その後の細胞回収、洗浄、濃縮、充填(ダウンストリーム)が手作業のままでは、そこがボトルネックとなります。
真の効率化を目指すなら、培養装置とダウンストリームの装置をチューブで接続し、閉鎖系のまま連続的に処理できる統合システムの構築が理想的です。これにより、製品が外気に触れるリスクを極限まで減らし、最終製品までのトータルスループットを向上させることができます。
まとめ

本記事では、再生医療製品の商用化に向けた細胞培養のスケールアップ戦略について解説してきました。
- 3次元培養への移行: 平面培養の限界を突破し、空間効率と生産性を最大化する。
- バイオリアクターの選定: 細胞特性に合わせ、せん断力や混合効率を考慮した最適な装置(シングルユース等)を選ぶ。
- 重要パラメータの管理: DO、pH、代謝産物を制御し、スケール変更前後での同等性を確保する。
- 自動化の推進: 手技のバラつきを排除し、堅牢で経済合理性の高いプロセスを構築する。
ラボスケールから商用生産への道のりは平坦ではありませんが、早期に適切なスケールアップ戦略を立てることで、開発期間の短縮とコスト競争力の強化が実現できます。患者様に一日も早く、高品質な再生医療製品を届けるために、製造プロセスの革新に取り組んでいきましょう。
細胞培養のスケールアップ戦略についてよくある質問

以下に、細胞培養のスケールアップに関して、プロセス開発担当者の方からよく寄せられる質問とその回答をまとめました。