再生医療製品の臨床応用が進む中で、製造プロセスの核心となる「培地」の選定は、プロジェクトの成否を分ける極めて重要な意思決定です。従来の血清添加培地から、より安全で均一な無血清培地やゼノフリー培地への移行は、規制要件への適合だけでなく、製品品質の安定化においても避けて通れない道といえるでしょう。
しかし、市場には多種多様な培地が存在し、どの製品が自社の細胞やプロセスに最適なのか、迷われる開発担当者様も少なくありません。
本記事では、再生医療の現場で求められる「無血清培地・ゼノフリー培地の選び方」について、規制対応、性能評価、コストなどの多角的な視点から、プロフェッショナルな視点で解説いたします。臨床グレードへの移行をスムーズに進めるための、実践的な判断基準としてお役立てください。
無血清培地・ゼノフリー培地選びの結論:臨床開発を成功させるための優先順位
再生医療製品の開発において、培地選定は単なる試薬選びの枠を超え、将来の承認申請や商用生産を見据えた戦略的な判断が求められます。結論から申し上げますと、臨床開発を成功させるための優先順位は、「規制適合性(安全性)」、「供給安定性(GMP/BCP)」、そして「細胞特性の維持(性能)」の3点に集約されます。
研究段階では細胞の増殖速度やコストが重視されがちですが、臨床ステージへ進むにつれて、原材料のトレーサビリティやロット間の均一性がよりクリティカルな要素となります。特に、PMDAやFDAなどの規制当局が求める生物由来原料基準への適合は、開発初期段階から考慮しておくべき必須事項です。
後工程での変更は、同等性評価に膨大な時間とコストを要するため、開発の初期段階から「ゴール(承認・上市)」を見据えた培地選定を行うことが、結果として最短ルートでの開発成功につながります。本記事では、これらの優先順位に基づいた具体的な選定プロセスを紐解いてまいります。
再生医療の臨床応用において脱血清化が必須となる理由
なぜ今、再生医療の臨床現場で従来の血清培地からの脱却が強く求められているのでしょうか。その背景には、安全性リスクの低減と製造品質の安定化という、医薬品製造における二つの大きな課題が存在します。ここでは、脱血清化が必須となる主な理由について、規制とプロセスの観点から解説いたします。
ウシ胎児血清(FBS)使用に伴う生物由来原料基準のリスク管理
ウシ胎児血清(FBS)は、細胞増殖に優れた効果を発揮する一方で、未知のウイルスやプリオンなどが混入するリスクを完全には排除できません。再生医療等製品の製造においては、生物由来原料基準への適合が厳格に求められており、動物由来成分の使用は可能な限り避けることが推奨されています。
特に、異種動物由来の成分が含まれる場合、患者様への投与時に免疫反応を引き起こす可能性や、人獣共通感染症のリスクが懸念されます。これらのリスクを最小限に抑え、規制当局への安全性説明を円滑に進めるためにも、脱血清化は避けて通れないプロセスといえるでしょう。
ロット間差の排除と製造プロセスの堅牢性(Robustness)確保
血清は天然由来の産物であるため、ロットごとに成分組成が異なり、これが細胞の増殖率や分化能に大きなバラつきを生じさせる原因となります。医薬品製造(GMP)において求められるのは、いつ誰が製造しても同じ品質の製品ができる「堅牢性(Robustness)」です。
無血清培地やゼノフリー培地を採用することで、培地成分が明確化され、ロット間差を劇的に低減することが可能です。これにより、製造プロセスの再現性が高まり、規格外製品の発生リスクを抑えることができるため、安定的な商用生産体制の構築に寄与します。
下流工程(ダウンストリーム)における精製負荷の軽減と安全性向上
細胞培養後の下流工程(ダウンストリーム)において、培地由来の不純物をいかに効率よく除去するかは、最終製品の安全性とコストに関わる重要な課題です。血清には多種多様なタンパク質が含まれており、これらが最終製品に残存することで、予期せぬ副作用を引き起こす可能性があります。
無血清培地やゼノフリー培地を使用することで、最初から混入するタンパク質の種類と量を制御できるため、洗浄や精製工程の負荷を大幅に軽減できます。これは、製品の純度を高めるだけでなく、製造コストの削減や工程の簡素化にもつながる大きなメリットとなります。
培地のグレード分類と用語の正しい理解
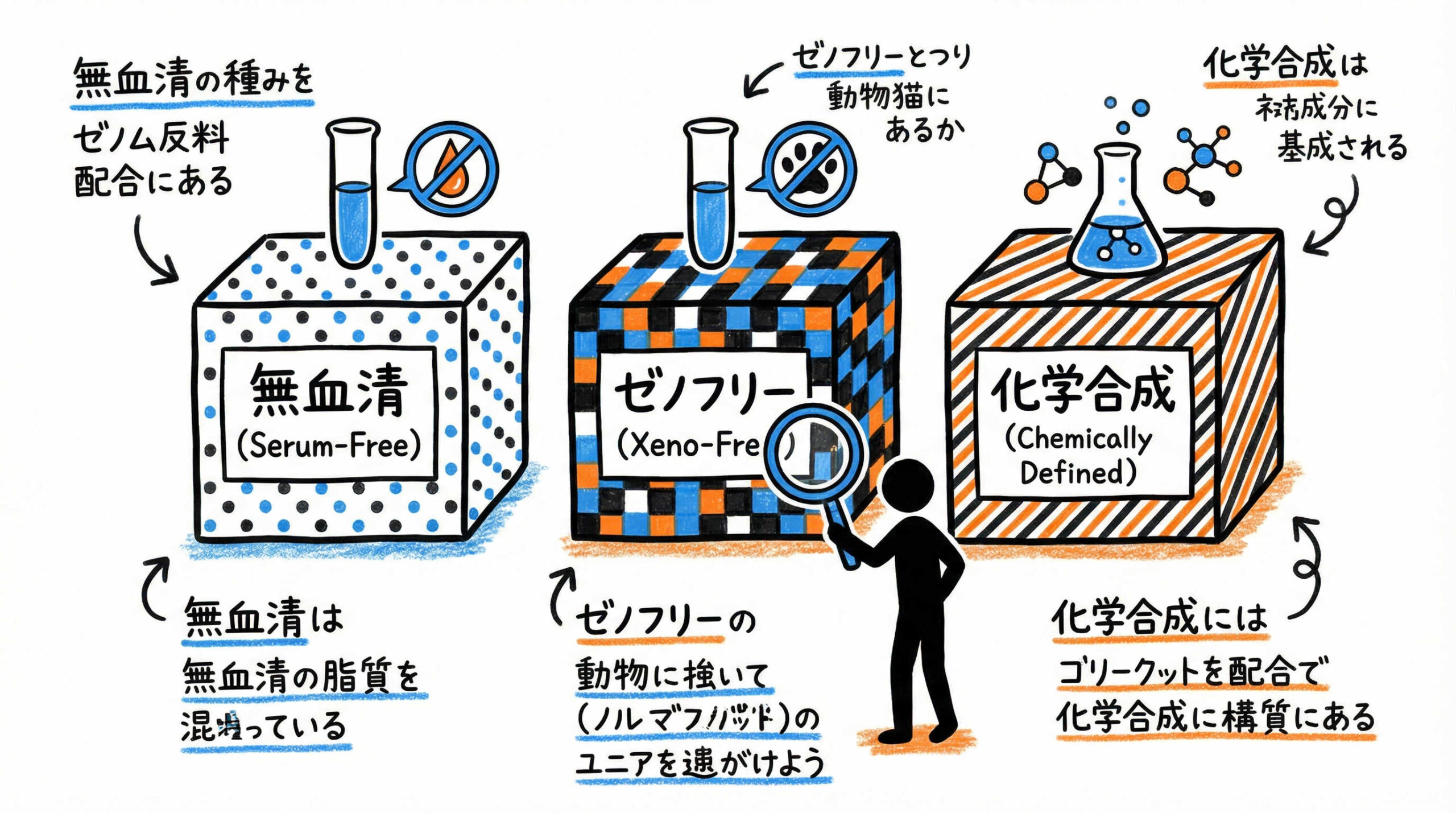
培地を選定する際、カタログスペック上の用語定義を正しく理解しておくことは、後々のトラブルを防ぐために非常に重要です。「無血清」と一口に言っても、そのグレードや含まれる成分の定義はメーカーや製品によって異なる場合があります。ここでは、主要なグレード分類とその定義について整理いたします。
無血清培地(Serum-Free Medium)の定義と特徴
無血清培地(Serum-Free Medium: SFM)とは、その名の通り血清(Serum)を含まない培地のことですが、必ずしも動物由来成分が含まれていないわけではありません。一般的に、血清の代わりに精製されたアルブミンやトランスフェリン、インスリンなどのタンパク質や成長因子が添加されています。
注意が必要なのは、これらの添加因子が動物由来である場合がある点です。したがって、無血清培地であっても、生物由来原料基準への対応が必要となるケースがあります。選定の際は、「無血清」という言葉だけでなく、添加因子の由来まで確認することが大切です。
ゼノフリー培地(Xeno-Free Medium)の定義と異種動物由来成分の排除
ゼノフリー培地(Xeno-Free Medium)は、ヒト以外の異種動物由来成分(Xeno-)を一切含まない培地を指します。ヒト由来成分(ヒト血清アルブミンやヒト血小板溶解物など)や、組換えタンパク質は使用されますが、ウシやブタなどの動物由来成分は排除されています。
再生医療においては、異種タンパク質による免疫原性リスクを回避できるため、臨床応用において推奨されるグレードの一つです。ただし、ヒト由来成分を使用する場合は、そのドナーのスクリーニングやウイルス検査が適切に行われているかを確認する必要があります。
アニマルフリー(Animal-Origin Free)とケミカリーディファインド(CDM)の違い
さらに厳密な定義として、アニマルフリー(Animal-Origin Free: AOF)とケミカリーディファインド(Chemically Defined Medium: CDM)があります。アニマルフリーは、ヒトを含むあらゆる動物由来成分を含まない培地です。一方、CDMは、含まれるすべての成分が化学的に同定されており、構造が明確な物質のみで構成された培地を指します。
CDMはロット間差が最も少なく、再現性が極めて高い理想的な培地ですが、細胞によっては増殖性能が劣る場合もあります。開発フェーズと目的に応じて、どのレベルの定義が求められているかを見極めることが肝要です。
失敗しない無血清・ゼノフリー培地の選定基準【チェックリスト】

数ある製品の中から、自社のプロジェクトに最適な培地を選び抜くためには、明確な基準を持つことが大切です。臨床応用を見据えた場合、単に細胞が増えればよいというわけではありません。ここでは、失敗しないための選定基準を5つのチェックリストとしてまとめました。
規制対応:PMDA/FDAガイドライン適合とマスターファイル(MF)登録
まず確認すべきは、各国の規制ガイドラインへの適合状況です。特に日本国内での製造販売承認を目指す場合、PMDAの生物由来原料基準への適合性は必須となります。また、海外展開を視野に入れている場合は、FDAなどの規制にも対応できるか確認が必要です。
メーカーが規制当局に対して、培地の詳細な製造情報(マスターファイル:MF)を登録しているかどうかも重要な判断材料です。MF登録済みの製品であれば、承認申請時にメーカーから当局へ直接情報提供が行われるため、審査の手続きがスムーズに進むメリットがあります。
組成開示:成分のトレーサビリティと安全性証明書(CoA/CoQ)
培地の構成成分がどこまで開示されているか、そしてそのトレーサビリティが確保されているかも重要です。完全な組成開示が難しい場合でも、少なくとも生物由来原料の有無や起源については明確な情報提供が求められます。
製品ごとに試験成績書(CoA)や品質証明書(CoQ)が発行され、エンドトキシン試験、無菌試験、マイコプラズマ否定試験などが適切に実施されているかを確認しましょう。これらの文書は、品質管理の根拠として規制当局への提出資料にも活用される重要なものです。
性能評価:対象細胞の増殖速度・形態・表現型の維持
規制対応が万全でも、肝心の細胞が増殖しなければ意味がありません。評価試験では、単に増殖速度(Doubling Time)を比較するだけでなく、細胞形態の変化や、特異的な表面マーカーの発現維持、分化能の保持などを総合的に評価する必要があります。
特に継代を重ねた際の核型異常の有無や、老化マーカーの発現状況なども長期的な視点でチェックしましょう。短期間のデータだけでなく、商用製造を想定した継代数での安定性を確認することが、リスク回避につながります。
供給体制:GMP製造対応とBCP(事業継続計画)の確認
臨床試験や商用生産に入った後で、培地の供給がストップすることは許されません。メーカーがGMP準拠の製造体制を持っているか、そして安定供給のためのBCP(事業継続計画)を策定しているかを確認することは、ビジネスリスク管理の観点から不可欠です。
製造拠点が複数あるか、在庫の確保状況はどうか、輸送時の温度管理体制は整っているかなどを事前にヒアリングしておきましょう。信頼できるパートナーとしてのメーカー選定が、長期的なプロジェクトの安定性を支えます。
コスト試算:研究用から商用生産へのスケールアップ時の経済性
最後に、コストパフォーマンスの検証です。研究用試薬としての価格だけでなく、将来的に数百リットル、数千リットル規模で製造する場合のスケールメリットや、特注対応の可否なども含めて試算する必要があります。
高価な培地であっても、増殖効率が高く製造期間を短縮できれば、トータルの製造原価(CoG)は安くなる場合もあります。培地単価だけでなく、人件費や設備稼働時間を含めた全体コストでの比較検討をお勧めいたします。
対象細胞・用途別に見る培地選定の具体的なポイント
細胞の種類によって、培地に求められる栄養要求性やシグナル因子は大きく異なります。汎用的な培地ではなく、対象とする細胞の特性に特化した製品を選ぶことで、より効率的で高品質な培養が可能になります。ここでは主要な細胞種ごとに、選定のポイントを具体的に解説します。
間葉系幹細胞(MSC):継代数による老化抑制と分化能のバランス
間葉系幹細胞(MSC)の培養においては、高い増殖能を維持しつつ、早期の老化や自然分化を抑制することが課題となります。特に、骨髄、脂肪、臍帯など由来組織によって最適な栄養条件が異なる場合があるため、由来組織にマッチした培地を選ぶことが重要です。
選定の際は、継代数を重ねても線維芽細胞様(Spindle shape)の形態を維持できるか、また骨・軟骨・脂肪への三系分化能が保たれているかを重点的に評価しましょう。また、免疫調整能などの機能面での評価も併せて行うことが望ましいです。
ヒト多能性幹細胞(iPS/ES):未分化維持能力とシングルセル継代の可否
iPS細胞やES細胞などの多能性幹細胞では、未分化状態(Pluripotency)の維持が最優先事項です。bFGF(塩基性線維芽細胞増殖因子)などの添加因子の安定性や、フィーダーフリー培養への適合性が選定の鍵となります。
また、近年の大量培養技術の進展に伴い、シングルセル継代が可能な培地への需要が高まっています。細胞塊(クランプ)での継代に比べ、シングルセル継代は自動化との相性が良いため、将来的な自動培養装置への導入を検討されている場合は、この点も重要な評価項目となります。
免疫細胞(T細胞・NK細胞):活性化効率と特定サブセットの誘導
CAR-T療法などに用いられるT細胞やNK細胞の培養では、細胞の増殖だけでなく、高い活性(Killing activity)や特定のサブセット(メモリーT細胞など)への誘導効率が求められます。
培地選定においては、IL-2やIL-15などのサイトカインとの相性や、活性化ビーズなどの刺激因子に対する応答性を確認する必要があります。また、最終製品の品質に直結する、疲弊マーカーの発現を低く抑えられる培地であるかどうかも、重要な選定ポイントといえるでしょう。
造血幹細胞(CD34+):サイトカイン添加の必要性と増幅効率
造血幹細胞(HSC)の体外増幅は技術的に難易度が高く、適切なサイトカインカクテル(SCF, TPO, FLT3Lなど)の添加が必須となります。培地自体が、これらのサイトカインの効果を最大限に引き出せる基礎組成を持っているかが問われます。
特に、CD34陽性細胞の純度を維持しながら効率的に増幅できるか、また移植後の生着能(Engraftment)に関わる幹細胞性を維持できるかが評価の分かれ目となります。無血清条件下での培養実績が豊富な製品を選ぶことが、成功への近道です。
培地変更に伴うプロセス最適化と周辺試薬の選定
培地を血清入りから無血清・ゼノフリーへ変更することは、単にボトルの中身を変えるだけではありません。細胞にとっては生育環境の激変であり、それに合わせたプロセス全体の最適化が必要となります。培地変更を成功させるために見落としてはいけない、周辺試薬との適合性について解説します。
血清培地からの馴化(Adaptation)プロトコルの策定と評価
血清培地で維持されていた細胞を、いきなり100%無血清培地に移すと、細胞死や増殖停止(ショック)を起こすことがあります。これを防ぐために、段階的に新しい培地の比率を上げていく「馴化(Adaptation)」プロセスが必要です。
例えば、血清培地と無血清培地を50:50で混合して継代し、細胞の状態を見ながら徐々に無血清培地の比率を高めていく方法が一般的です。この馴化期間中に細胞の特性が変化しないよう、慎重にモニタリングを行うプロトコルを策定しましょう。
ゼノフリー対応の細胞剥離剤・解離液(組換えトリプシン等)の選択
培地をゼノフリー化しても、継代時に使用するトリプシンがブタ由来であっては意味がありません。完全なゼノフリープロセスを構築するためには、細胞剥離剤も組換え酵素(リコンビナント・トリプシン)や植物由来酵素などの非動物由来製品に変更する必要があります。
ただし、これらの酵素は従来のトリプシンとは作用機序や強さが異なる場合があります。細胞へのダメージを最小限に抑えつつ、効率的に剥離できる最適な処理時間や濃度を再検討することが大切です。
細胞接着基質(コーティング剤)との適合性確認
無血清培養、特にiPS細胞やMSCの培養においては、細胞が足場に接着するためのコーティング剤(基質)が極めて重要です。血清中には接着因子が含まれていますが、無血清培地ではそれらが不足するため、ラミニン、フィブロネクチン、ビトロネクチンなどの適切な基質を補う必要があります。
選定した培地とコーティング剤には相性があります。メーカーが推奨する組み合わせを採用するのが基本ですが、コストや作業性を考慮して独自の組み合わせを検討する場合は、接着効率や増殖性を十分に検証してください。
凍結保存液のケミカリーディファインド化と生存率の検証
プロセスの最後を締めくくる凍結保存工程においても、血清(DMSOを含むFBSなど)の使用は避けるべきです。現在は、化学的に組成が定義された(CDM)凍結保存液が多く市販されています。
無血清培地で培養した細胞は、血清培地の細胞と比較して膜の状態などが異なる場合があり、凍結融解のストレスに対する感受性が変わることがあります。新しい培地で培養した細胞を用いて、凍結保存液との適合性と融解後の生存率(Viability)を必ず再検証しましょう。
まとめ

無血清培地・ゼノフリー培地の選定は、再生医療製品の品質、安全性、そして将来の商業化を左右する戦略的なステップです。最適な培地を選ぶためには、単にスペックを比較するだけでなく、規制対応、供給体制、そして自社の細胞との相性を多角的に評価することが不可欠です。
初期段階での慎重な選定と検証は、一見遠回りに見えるかもしれませんが、後の臨床開発における手戻りを防ぎ、結果として最短での実用化につながる確かな道筋となります。本記事でご紹介したチェックリストや視点を活用いただき、貴社のプロジェクトにとってベストなパートナーとなる培地を見つけ出してください。
無血清培地・ゼノフリー培地の選び方についてよくある質問

無血清培地やゼノフリー培地の導入を検討されている方から、頻繁に寄せられる質問とその回答をまとめました。導入前の疑問解消にお役立てください。
よくある質問
-
Q1. 無血清培地に切り替えると、細胞の増殖速度は落ちますか?
- A1. 一時的に落ちる場合がありますが、適切な馴化(Adaptation)を行うことで回復することが多いです。近年は血清培地と同等以上の増殖性能を持つ高性能な無血清培地も多く開発されています。
-
Q2. 研究用グレードの培地で臨床試験を行うことは可能ですか?
- A2. 原則として推奨されません。臨床試験には、製造管理および品質管理の基準(GMP)に準拠して製造された、臨床グレードまたはそれに準ずる品質の培地を使用する必要があります。
-
Q3. ゼノフリー培地を使用すれば、ウイルス安全性試験は不要になりますか?
- A3. 不要にはなりません。リスクは低減されますが、最終製品の安全性を示すために、ガイドラインに基づいたウイルス否定試験やマイコプラズマ否定試験などは依然として必要です。
-
Q4. メーカーのマスターファイル(MF)登録がない培地は使えませんか?
- A4. 使用自体は可能ですが、承認申請時に詳細な成分情報の開示を求められた際、メーカーからの情報提供が不十分だと審査が遅れるリスクがあります。可能な限りMF登録済みの製品を選ぶのが無難です。
-
Q5. 培地のコストダウンを図るにはどうすればよいですか?
- A5. 培地単価だけでなく、増殖効率向上による培養期間の短縮や、培地交換頻度の削減などを総合的に検討しましょう。また、大量購入時のボリュームディスカウントについてメーカーと交渉するのも有効です。